⑦サージカルマスク着用によりほぼfull PPEに近い感染防止効果がある。
医療従事者のCOVID-19罹患率は感染者全体の3.5〜20%を占めると報告されている。COVID-19専任の医療従事者の場合、一定量の感染性飛沫を放出している感染者と同居している家庭環境に近い条件下にあると考えられ感染リスクは極めて大きい。サージカルマスク着用による医療従事者の感染防止効果に関してのコンピュータシミュレーション解析の結果を近大が報告している(16)。
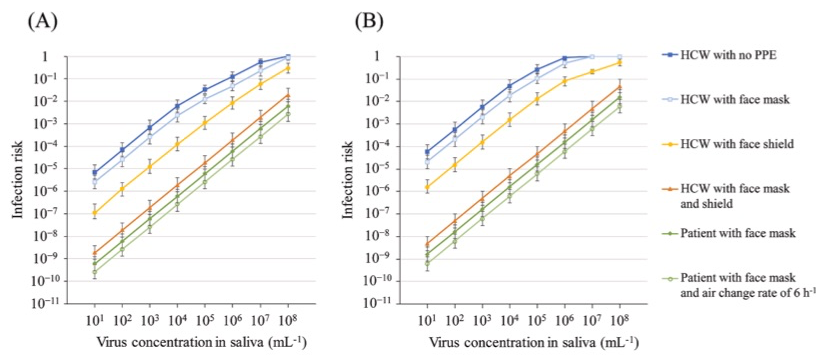
図11は、medium contact time (MCT)およびlong contact time (LCT)の2つの暴露時間を考慮したシナリオで種々の感染防具の感染回避率をグラフ化してある(16)。MCTは、医療従事者が1日に20回、1回1分の設定で感染者の病室を訪問する状況でtotalの暴露時間は20分、LCTは1日6回、1回10分の設定で感染者の病室を訪問する状況でtotalの暴露時間は60分と設定している。病室体積は最も標準的な22.7m*3で、換気回数は最低数の2回/時としてシミュレートしてある。いずれの状況においても(自明のことかもしれないが)、防具を追加するほど感染リスクは低下している。注目すべきことはフェイスマスク(サージカルマスク)をするだけで大きく感染リスクが低下していることである。
今回の一時的収束期間の間に解決を急ぐ重要問題は、
①COVID19感染が成立するウイルス暴露量の最低値を決定すること
②バイオエアロゾル感染のリスクの程度と感染防止対策をはっきりさせること
③東アジア諸国と西洋諸国で桁外れの格差を見せる市中感染の拡張性の差をもたらしている原因を解明すること
イギリスはすでにボランティアを募って①を解決する人体実験を始める様であるが、①〜③の問題を解決し日本独自の感染防止対策を確立する必要がある。そもそも欧米諸国とは異なる拡散状況である限りWHOの一般原則と一致させる必要性はないかもしれない。
part-2では言語から生じるエアロゾル の発生数の方向から東アジアにおける非常に鈍い拡散状況の原因に関して考えてみる。
Uploaded on February 26, 2021.
参考文献
1. Wei J, Li Y. Airborne spread of infectious agents in the indoor environment. Am J Infect Control 2016; 44: pp102-pp108
2.Subramaniam S. Lagrangian–Eulerian methods for multiphase flows. Progress in Energy and Combustion Science 2013; 39(2-3): pp215-pp245. DOI: 10.1016/ j.pecs.2012.10.003.
3. Dbouk T, Drikakis D. On coughing and airborne droplet transmission to humans. Phys Fluids 2020; 32, 053310: pp1-pp10
4. Atkinson J, Chartier Y, et al. Natural ventilation for
infection control in health-care settings. WHO Publication/Guidelines. World Health Organization 2009.
5. Gralton J, Tovey E, et al. The role of particle size in aerosolised pathogen transmission: A review. J Infect 2011; 62: pp1-pp13
6. Wei J, Li Y. Airborne spread of infectious agents in the indoor environment. Am J infect Control 2016; 44 S: pp102-pp108
7. Jhonson GR, Morawska L, et al. Modality of human expired aerosol size distributions. J Aerosol Sci 2011; 42: pp839-pp851
8. Chen W, Zhang N, et al. Short-range airborne route dominates exposure of respiratory infection during close contact. Build Environ 2020; 176, 106839: pp1-pp16
9. S. Asadi, A. S. Wexler, et al. Aerosol emission and superemission during human speech increase with voice loudness. Sci Rep 2019; 9, 2348: pp1-pp11
10. Chen M, Shen W, ea al. Elevated ACE-2 expression in the olfactory neuroepithelium: implications for anosmia and upper respiratory SARS-CoV-2 entry and replication. Eur Respir J 2020; 56-2001948: pp1-pp4
11. Wang W, Xu Y, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA 2020; 323: pp1843–pp1844
12. Bourgon AR, Abdulleje AE, et al. Angiotensin-converting enzyme 2 (ACE2), SARS-CoV-2 and the pathophysiology of coronavirus disease 2019 (COVID-19). J Pathol 2020; 251: pp228–pp248
13. Dbouk T, Drikakis D. On respiratory droplets and face masks. Phys Fluids 2020; 32, 063303: pp1-pp11
14. Zangmeister CD, Randney JG, et al. Filtration Efficiencies of Nanoscale Aerosol by Cloth Mask Materials Used to Slow the Spread of SARS-CoV-2. ACS Nano 2020; 14: pp9188−pp9200
15.Mittal R, Meneveau C, et al. A mathematical framework for estimating risk of airborne transmission of COVID-19 with application to face mask use and social distancing. Phys Fluids 2020: 32,101903; pp1-pp15
16. Mizukoshi A, Nakama C, et al. Assessing the risk of COVID-19 from multiple pathways of exposure to SARS-CoV-2: Modeling in health-care settings and effectiveness of nonpharmaceutical interventions. Environ Internat 2021; 147,106338: pp01-0014