(3)mRNAワクチンの構造について
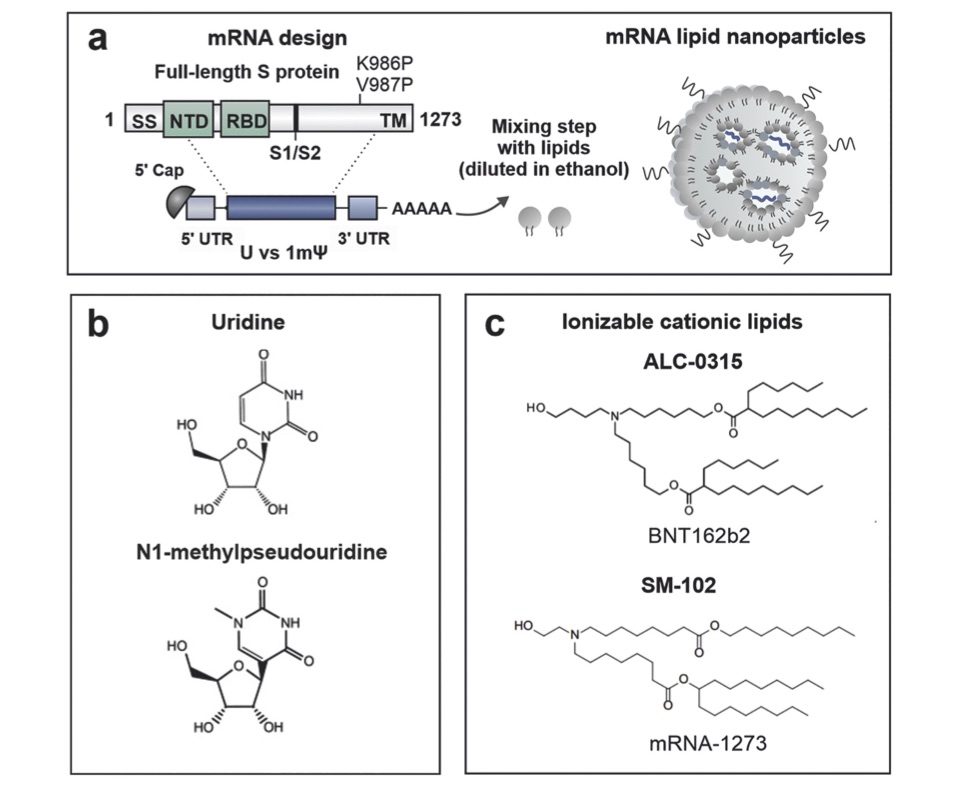
mRNAワクチンのデザインは。下図4aの如くS蛋白の全領域の塩基配列を含むが986番目と987番目に読み込まれる糖原性アミノ酸をP(プロリン)で置換することで灌流安定性を図るとともに人口産物としてのマーキングとして挿入されている(4)。mRNAの安定性と転写効率を維持する構造として5′-末端にCAP構造, 3’末端にAが連続したpoly(A)tailを付加し、非転写領域であるUTRで転写領域を挟み込む形になっている。図4bの様に、ファイザー社は転写領域のウリジンをn1-methylpsudouridineに変更する工夫によりmRNAの転写効率を大幅に改善させている(1mΨ)。このmRNAを脂質とミックスさせることで負に帯電したmRNAを正に帯電したイオン化脂質の粒子に閉じ込めmRNA-LNPs(lipid nanoparticle)と呼ばれる微粒子として作成される。図 4cはそれぞれのワクチン に使用されている陽イオン化脂質が示してある。mRNA/lipid =0.05[wt/wt]に調整されている。また、PEG(Polyethylene glycol)は、ワクチンの製造過程や保存における微粒子の凝集を防ぐ目的で添加されているが、局注の際にすぐにワクチン微粒子から乖離する。ちなみに、ファイザー社のワクチンはBNT162b1とBNT162b2があり、前者はRBD領域(RBD trimer mRNA)のみ、後者はスパイク蛋白全体の塩基配列(full length S protein mRNA)をデザインしてある。
(4)mRNAワクチン注射部位の局所反応について
ワクチン施注部位では、mRNA-LNPsが一過性の炎症反応を引き起こす。これは注射した筋組織の内部に常在している抗原提示細胞(APC)や樹枝状細胞(DC)などにエンドサイトーシスにより取り込まれることで細胞内にS蛋白を発現しこれを元々備わっている免疫細胞に対して異物(非自己)として抗原提示する(4)。この様にして感作されたAPCなどが筋注部位の所属リンパ節(三角筋であれば腋窩リンパ節)に移動しB細胞やT細胞を活性化させることで一過性の炎症反応の生じる範囲および程度の増強が起こる(図5a)。mRNA自体はI型インターフェロン(IFNs)を高度に産生誘導する性質がある(I型IFNsは感染細胞でのウイルス増殖を抑制する作用がある)(4)。これにより発熱、関節痛、筋痛などの症状が引き起こされる。I型IFNは細胞障害性T細胞活性化の原動力として作用すると考えられている。
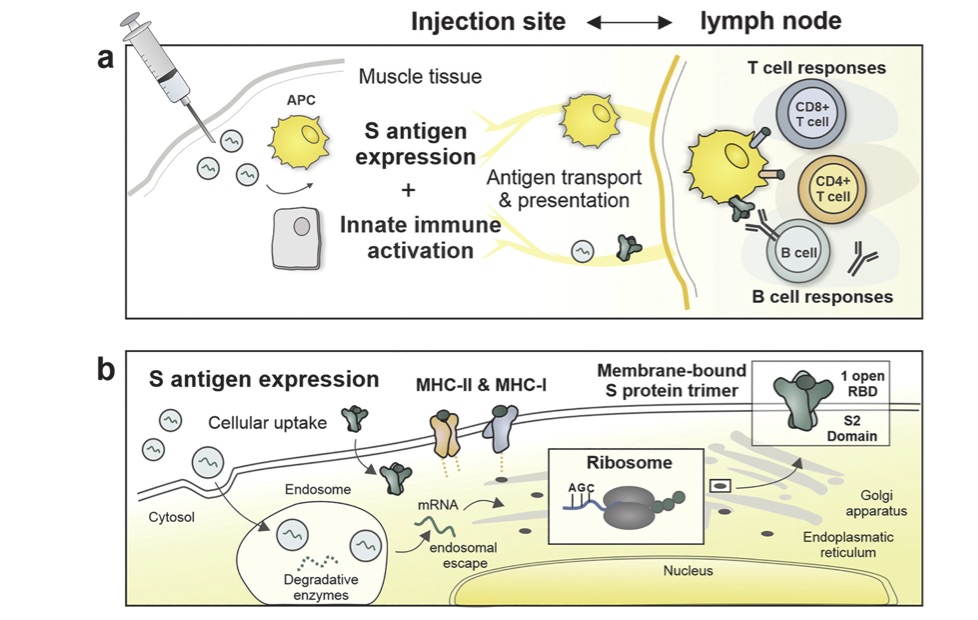
一方筋細胞内に侵入したmRNA-LNPsの多くはエンドゾームで捕捉され変性される運命にあるが、mRNAが正に帯電したプロトン化脂質粒子に閉じ込めてあることで負に帯電している膜側に粒子は移送され変性を逃れてリボゾームに到達できる(図5b)。この様にしてリボゾームで複製されたS蛋白が3量体として細胞膜表面に発現する。これによりB細胞、T細胞に非自己として認識させる抗原提示が可能となる。最終的にS蛋白が発現した細胞は異物とみなされこれらの免疫担当細胞による排除(アポトーシス)に至る。
十分量のmRNA-LNP微粒子が、細胞内に到達しリボゾームでtRNAによりスパイク蛋白が多く産生されなければ十分な抗原ー抗体反応を引き出すことはできない。したがって上記で説明した本来生体に備わっている異物に対する免疫反応から逃れるか、抑制する何らかのテクノロジーがこの微粒子に備わっている必要がある。LNP化は接種を受けた者の1型インターフェロンの産生を抑制する効果があり、このためワクチン接種後はしばらくすべてのウイルス感染に対して増殖抑制能力が低下すると推定される。恐らくこの一連のサイトカイン応答の低下が、ワクチン接種時に無症候性で完結するはずであったCOVID-19感染を顕在化させたり、潜伏しているウイルス疾患を急性増悪させる様な副反応(AE)を引き起こしているのではないかと推測する。