新型コロナウイルス感染症(COVID-19)のパンデミックに対して、2020年にメッセンジャーRNA(mRNA)ワクチンが全世界的にワクチンキャンペーンとして政府指導で導入されて以来5年になる。一方COVID-19感染後、数週間に渡って持続する全身倦怠感やブレインフォグ(認知機能障害)に関してはLong-COVIDという病名カテゴリーが約半年後には創設されたにもかかわらず、mRNAワクチン接種後数週間以上にわたり持続する類似の症状を示す症候群(いわゆるワクチン後遺症)に関しては未だに病名カテゴリーとして認可を受けてはいない。これらに関して、近年海外論文からレビューされたものが目につくようになってきたので2024年末までにアクセプトされている論文に関してPubmedで閲覧可能な範囲で検索し最近の動向に関してUpdateを行った。一般論としてのワクチン副反応の総括として、またワクチン後遺症に難渋する方々に微力ながらお力添えできましたら幸いと存じます
(1)ワクチン接種後の死亡症例の経時分布
Fukushimaら(1)は、2021年7.21までに公表された厚労省のワクチン接種後死亡症例に関してのデータをまとめて報告している。7.21の時点でPfizer社(BNT162b2)接種後死亡報告は、1回目接種後で488例、2回目接種後で214例、接種回数不明(1回または2回のそちらかの記載がないもの)の死亡は44例であった。一方Moderna社(mRNA-1273)接種後の死亡報告は、1回目接種後で5例、2回目接種後で0例であった。以上の報告データをmRNAワクチン接種日を”0″または”1″としてその近辺でどれだけ死亡方向があるかを度数分布を棒グラフしたものが以下の図1[A]である。左の棒グラフは我が国のmRNAワクチン接種後に報告された死亡症例(必ずしすべてがワクチン関連死とは限らない)を経時的に表すものであるが接種翌日をピークとして接種後2週間かけて漸減していく傾向がみられる。
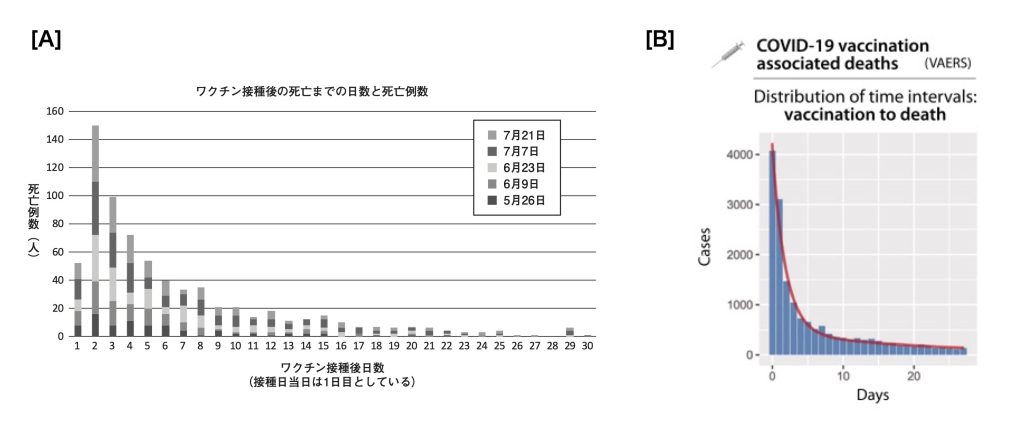
[A]日本で2021年7.21までに報告された関連死の時系列分布
Fukushima M, et al. Overview of COVID-19 post vaccination mortality and pharmacoepideiological evaluation: nation-wide view and a proposal. Clin Eval 2022; 49(3): pp499-517のFig 2より引用
[B]USAでVARESに報告された関連死の時系列分布
Schokmann F, et al. COVID-19, post-acute COVID-19 syndrome(PACS, “long COVID”) and post-COVID-19 vaccination syndrome (PCVS, “post-COVIDvac-syndrome”): similarities and differencies. Pathology-Reserch and Practice 2023;246のFig. 3より引用
図1[B]はVARES(ワクチン副反応報告システム:USA)によるワクチン接種日を”0″として死亡報告症例の度数分布をヒストグラムにしたものであるが2重指数関数にしたがって経時的に減衰していく現象が認められる(2)。ワクチン接種後は多少の報告バイアスがかかるのは当然であるが日本をはじめ米国、その他で同様の傾向がみられることに関しては特筆すべき傾向であろう。おそらく接種後20日以降は死亡報告数が横ばいで定常状態となっていることを考慮するとこれ以降の報告数がワクチンの介在事象がない場合の平均的な1日の死亡数を示していると考えられる。
一方、2021年7.21までに公表された厚労省のワクチン接種後死亡症例に関してのデータとCOVID-19感染による死亡者数比較から、新型コロナワクチン接種に伴う死亡事故がCollateral damage(いわゆる勝利のための犠牲)として容認できるかという検討基準となるものとして表1を示す。

そのワクチン接種後死亡とインフルエンザおよびそのワクチン接種後死亡
Fukushima M, Hirai y, et al. Overview of COVID-19 post vaccination mortality and pharmacoepidemiological evaluation: nation-wide view and a proposal. Clin Eval 2022; 49(3): pp499-517のtable 1より引用
60代以上の年齢においては人口10万人に対してCOVID-19感染死は27.859発生しており、ワクチン関連の死亡事故は1.725であるから、mRNAワクチンがphaseIII レポート相当の入院/死亡を80~90%回避する能力を保持しているなら(see→ Case 24-11) その6%にあたる死亡事故はこの年齢層に対しては許容できる数値?であるかもしれない。しかながら50代以下の年齢層に関して、COVID-19 感染死亡 0.537 < ワクチン関連の死亡事故 1.725は、容認できる数値であったかどうかはこの時点で検討すべき数値であったように感じられる。
(2)mRNAワクチンと接種により体内で産生されたスパイクタンパクの体内動態について
Alfred jら(3)は、C型肝炎患者のHCV-RNA定量のために採血された血液からSARS-COV2スパイクタンパクの遺伝子配列全長が得られたと報告している(ただし肝炎の進行度がどのくらいかに関しては言及されていない)。これらは最長でワクチン接種後28日後まで血液中から検出できた。108名のC型肝炎患者の血液サンプルのうち10名からスパイクタンパクの遺伝子配列が得られたがその内訳を図2に示す。
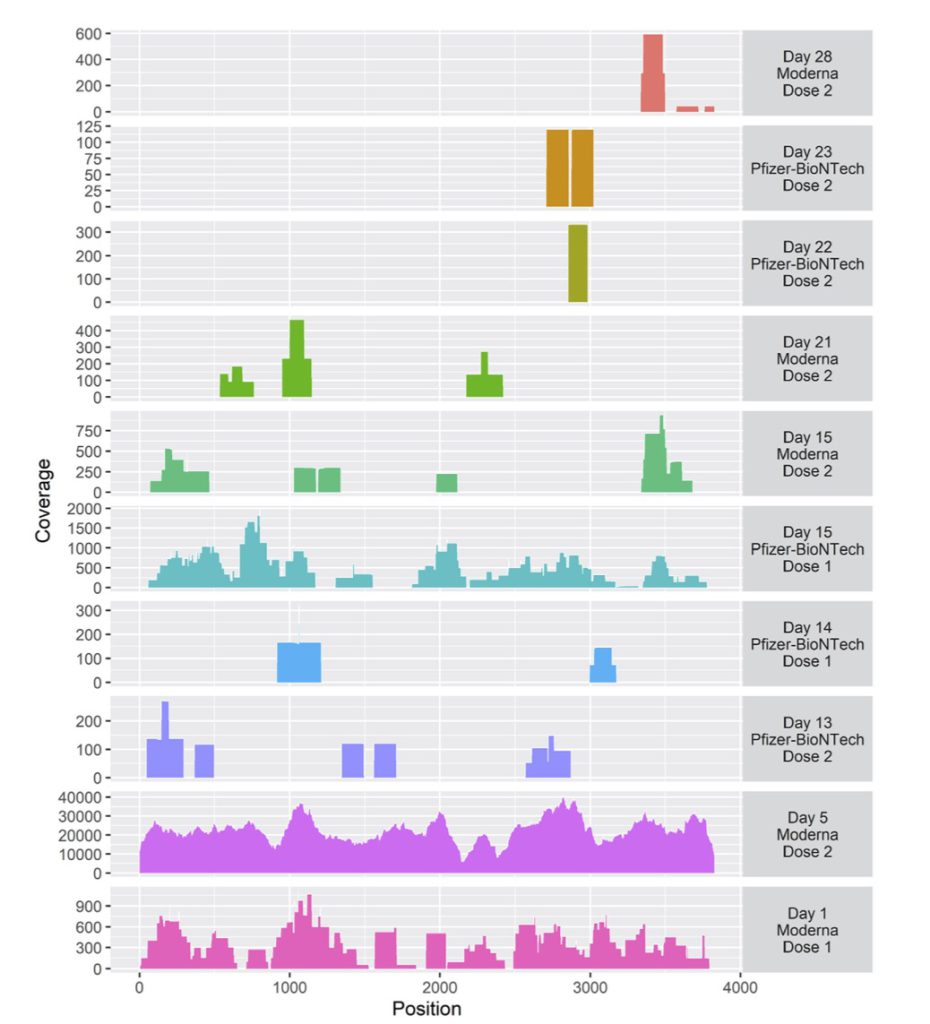
Pfizer/Moderna社共に肝炎患者に対してはルシフェラーゼの蓄積が肝臓に多く見られたため添付文書上は接種が推奨はされていなかったと思うが、このようにウイルスが慢性持続性感染した状態の個体の場合、ある程度の免疫寛容状態が成立していると考えられスパイクタンパクの排除が遅延するのかもしれない。
一方Yonker LMら(4)は、思春期〜若年者でCOVID-19 mRNAワクチン接種後心筋炎を発症した16例の患者の血液サンプル中で、抗体が付着していないスパイクタンパク全長の測定値が著しく上昇していたが、接種後に何も症状のないワクチン接種者ではスパイクタンパクは検出できなかったと報告している(図3)。
一般論として、ワクチン接種後にスパイクタンパクに対して特異的なIgG中和抗体(大部分はIgG1とIgG3)が産生される(see→ Case 24-8 vp2)ので理論的には抗体産生がピークに達する時点では血中スパイクタンパクは全て中和され遊離スパイクタンパク(中和抗体が結合していないもの)は検出できないはずではある。
図3で血中SARS-COV2抗原とは、mRNAワクチン接種により産生されたスパイクタンパク(S1領域部分または、S1領域を含むスパイクタンパク全長)を示す。
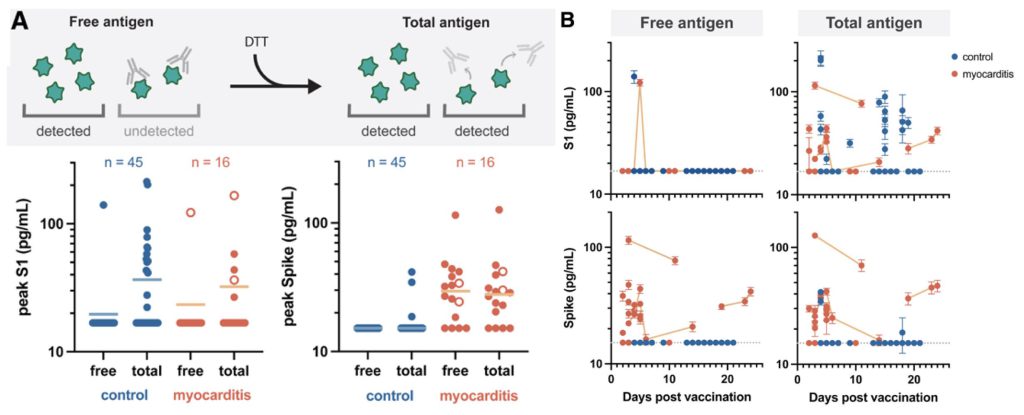
(A) ワクチン接種後何も症状を示していない健常者(n=44)と心筋炎を発症した患者(n=16)
(B)心筋炎発症患者の時系列変化:同一患者の測定値を線で結んで表示
Yonker LM, et al. Circulating spike protein detected in post-COVID-19 mRNA vaccine myocarditis. Circulation 2023; 147: pp867-876のFigure 4より引用。
心筋炎発症患者の血清freeスパイクタンパク抗原(全長 )の測定値は、33.9±22.9 pg/mLと著しく高値を示していた。一方健常者では測定できなかった。すなわち心筋炎患者の大部分は血中に中和抗体が結合していないfree antigenが循環していることを示すデータであった。心筋炎患者の一人は、接種後3週間後までfree antigenと中和抗体が結合したantigenの両方が測定可能であった。ただし、血中free antigenが、心筋炎に対してどのような影響を及ぼしたかに関しては言及されてはいない。
(3)mRNAワクチンの精製純度について
RNAが投与個体に対して1型インターフェロン(IFN-1)を介した強い炎症反応を引き起こすことは古くから証明されているが、kariko(5)らは、RNA塩基(A:アデニン、C:シトシン、U:ウラシル)に修飾(メチル化など)が加わることでこの炎症反応を小さくできることを発見した。特にウラシルの異性体であるシュードウリジン( Ψ)やメチルシュードウリジン(m1 Ψ)は、ウリジンと同様にタンパク翻訳作用を有する一方、投与個体のでの炎症反応を抑制するので、現在認可されているmRNAワクチン(Pfizer社のBNT162b2およびModerna社のmRNA-1273)に応用されている(see→ case 28-4)。mRNA精製過程で除去しきれずに残存するdsRNAは、投与個体に強い免疫反応を引き起こすことが知られており高速液体クロマトグラフィー(HPLC) を用いてろ過することでこれらの約90%の排除によりIFNの反応を抑制し転写効率を10〜1000倍に増強できるらしい(6)。
Pfizer社のBNT162b2 mRNAワクチンの製造方法に関してE.cottら(7)がニューヨークタイムズ誌面でレポートしているものが唯一ネットで検索できるが転写mRNAのリンシングの過程に関しては言及されてはいないのでどのような手法を用いて精製しているのかは公開されてはいないようである。
一般にmRNA原薬はプラスミドDNAを直線化した鋳型DNAに対しT7 RNAポリメラーゼ作用させるインビトロ転写により製造される(図4)。
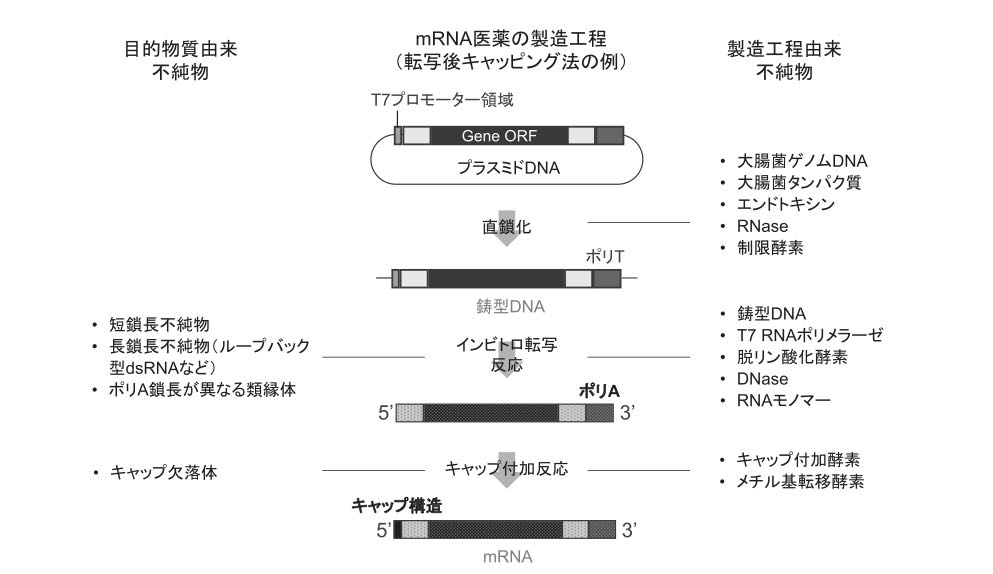
ループバック(loop back)とは、インビトロ転写で構成された目標のmRNAの3’末端がその上流の相補的な塩基配列を形成することを示す。このような現象が起こるとその部位を起点として逆鎖の合成が進行する(primer extension)。primer extensionは高頻度に起こりうる副反応であり問題を起こすdsRNAが形成される(8)。この様に目標物質では想定されていないdsRNAが生じることがあり、また5’末端のキャップ構造欠落体では3’リン酸が露出する。これらは核酸受容体(Toll様受容体(TLR)等)に認識され自然免疫の活性化により強い炎症反応を引き起こす(9)。
EMA(European Medicines Agency)はPfizer社のBNT162b2およびModerna社のmRNA-1273のmRNA COVID-19ワクチンには少量の2本鎖RNA(dsRNA)が含まれていると報告している(10, 11)。実際のところライセンス契約等の規約で国内のmRNAワクチンの販売を移管されている製薬会社でも恐らく製品純度に関して抽出再評価は許可されていないと思われ、この種の報告はネットで検索してもヒットしてこない。
McKernanら(12)は、モデルナ/ファイザー社の2価mRNAワクチン4バイアルの核酸純度分析を行った結果を報告している(図5)。

RNA電気泳動では小さなサイズのpeakが認められているがこれはN1メチルシュードウリジによるRNAの2次構造の変化もしくはDNAの質量電化比を反映したものと考えられた。これに対してDNAは広範囲に断片化がが認められている。ピークはプラスミドの全長を示すと考えられるが、m1 ΨとDNAの混在は分析試薬の相互干渉をおこしているかもしれない。Qbit(TM)3 fluorometryによる蛍光色素定量ではそれぞれ、21.8〜52.8 ng/μlのRNA、1〜2.8 ng/μlのDNA量と判定された。これらはEMAが規定している基準330ng/mg DNA/RNAを超過していた。
(3)mRNAワクチン接種後の長期副反応
2回接種(接種間隔3-4週間)を標準投与法としたmRNAワクチンキャンペーンが全国規模で始まるとphase-III study(see→ Case 24-8 vp1)では頻度が低い、または報告されていなかった想定外の副反応がカウントされるようになってきたことはすでに周知の事実であるがこの中には懸念すべき重篤な副反応がの存在が指摘されはじめた。これらは接種後1週間以内に完全に回復する全身倦怠感、高熱、局所の疼痛/腫脹といった軽傷レベルのものではなく数週間から半年以上に症状が及ぶもの、就業不能や、死亡に至るような症例を含んだいわゆる”ワクチン接種後症候群”として仮称されている範疇の副反応である。このような報告症例が相当数蓄積されつつある状況にあるにもかかわらず、接種開始後5年間に至ってもワクチン接種後症候群に関してはCOVID-19罹患後の後期不定愁訴を表現型とするLong-COVIDに対応するような妥当な病名カテゴリーは設けられておらず宙ぶらりん状態に放置されているのが現状といえる。
①いわゆる”ワクチン接種後症候群”の分類
COVID-19感染後長期にわたる副作用に関しては、下図上段のにあるようにPost-acute COVID-19 syndrome(PACS)またはlong COVIDとして病名がつけられており広く臨床医に認知されいるし、報道でもlong COVIDに関してはしばしば取り上げられているのは周知のことであろう。
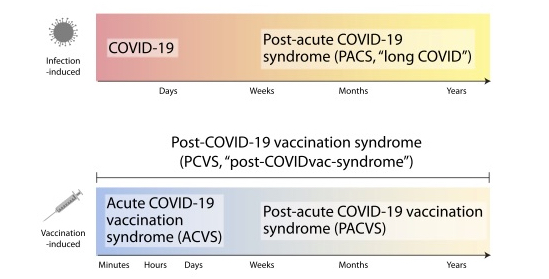
これに対してmRNAワクチン接種後から数週間をこえて持続する一部long COVIDと共通する症状を示す慢性疲労症候群を含む一連の病態に関しては未だに承認されていない状況にある。このような症状を示す集団が少なからず認められることがUSAをはじめ、その他の国でも確認されておりPACSに対応する疾患群として①Acute COVID-19 vaccination syndrome(ACVS):接種後数日以内に収まる疾患群、②Post-acute COVID-19 vaccination syndrome (PACVS):接種延々と続く疾患群に分類して対応していく方向性となりつつある(図6)。実際のところ問題となるのは後者のPACVSのほうでありこれにより就業や学業の継続が不可能となってしまった方が相当数存在するのは懸念されるべき事項である。PACVSの中核症状は、健康失調(易疲労感、慢性疲労)、心血管系の不調(起立性不耐症、頻脈/動悸)、末梢神経障害(知覚鈍麻/過敏)、中枢神経の機能不全(筋痛、筋力低下、筋攣縮)、消化管不定愁訴(嘔気、体重変化)などで構成される。
②mRNAワクチン接種後心筋炎/心膜炎について
Rose(13)らは、USAにおけるVaccine Adverse Event Reporting Sysytem[VAERS]に基づき、COVID-19ワクチン接種キャンペーンが始まる前の1990〜2020年、とそれ以後の2021〜2023年のワクチン副反応報告数および心筋炎の報告数の比較検討を行ったものを報告している(図7)。過去30年(1990~2020年)のすべてのワクチンの副反応報告を加算すると平均23,356例/年となるが、2021年のCOVID-19ワクチン単独の副反応報告は702,466例と1322%の著しい増加を認めている。2021年〜2023年8.11までの期間での報告のうち133,384例が心筋炎を含む心停止、不整脈などの心臓関連の副反応であった。
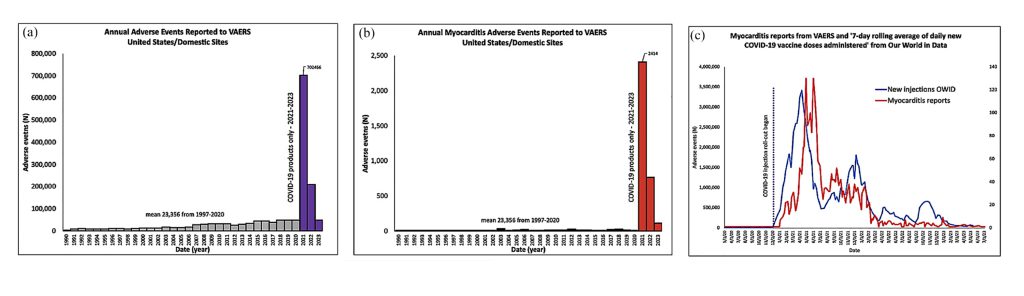
(a)ワクチン接種に由来する全ての副反応の報告数
1990〜2020の全ワクチンの副反応報告の合算(灰色)
2021〜2023.8.11のCOVID-19ワクチン単独の副反応報告数(紫色)
(b)ワクチン接種に由来する心筋炎の報告数
1990〜2020の全ワクチン接種の副反応として報告された心筋炎の報告数の合算(黒色)
2021〜2023.8.11のCOVID-19ワクチン単独の心筋炎の報告数(赤色)
(c)COVID-19ワクチンの接種者数(赤)と心筋炎の報告数(2020.5.1〜2023.7.3)
Rose J, et al. Determination of COVID-19 vaccine-induced myocarditis. Ther Adv Drug Saf 2024; 15: pp1-pp15のFigure 1より引用
2021〜2023.8.11までに合計で3,078名のワクチン由来の心筋炎が報告(全副反応報告の0.3%に相当)されており、このうち76%は救急部門等に入院し、3%が死に至っていた。これに対し1990年〜2020の期間では平均10.8症例であり、特筆すべき事実として2021年単独で2414症例の心筋炎の報告が確認されていた。(c)からはワクチン接種の軌跡(青線)に対して、心筋炎の報告数の軌跡が追従するような動向を示しているのがわかる。
次に、USAで使用されたワクチン種類別の心筋炎の特性について示す(表2)。Pfizer社のBNT162b2 mRNAワクチンの心筋炎発症が実数としては多くなっているがこれはBNT162b2の接種者がその他に比べて多いことが反映された結果と考えられるが大部分がmRNAワクチン接種に関連した報告であることは疑う余地もない。
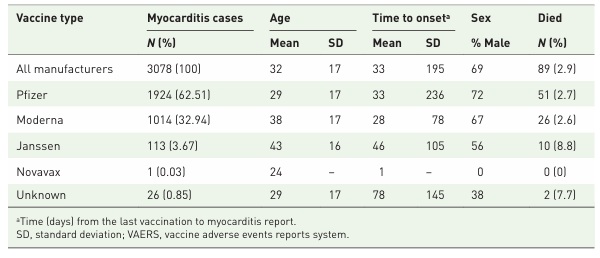
VAERSに報告のある心筋炎の発症件数、年齢、発症までの時間、死亡者数をワクチンの種類別に比較
組み換えタンパクワクチンであるNovavaxはワクチンにその他のワクチンに比べ心筋炎の発症は非常に稀であるように見える。Rose J, et al. Determination of COVID-19 vaccine-induced myocarditis. Ther Adv Drug Saf 2024; 15: pp1-pp15のTable 1より引用
また年齢別に階層化した心筋炎の報告数を見ると全体の30%は0〜20歳の思春期までの子供であり50%は0~30歳の若年男子が占めていた。12〜17歳の年齢層は最も心筋炎の報告が多い階層であった。731日の調査期間で12〜17歳の年齢層では571例の心筋炎の報告がありこれらは全体の12%を占めていた(図8)。

(a)CDCの年齢グループ別の全心筋炎の報告数
(b)ワクチン100,000回接種あたりに換算した心筋炎の報告数
Rose J, et al. Determination of COVID-19 vaccine-induced myocarditis. Ther Adv Drug Saf 2024; 15: pp1-pp15のFigure 3より引用
またCOVID-19ワクチン接種回数(ドーズ)毎の心筋炎の報告数を見ると2ドーズ接種後の報告数が飛び抜けて多いことがわかる(図9)。1ドーズ後の心筋炎の報告は70%が接種後7日以内、43%は接種後48時間以内であった。また2ドーズ接種に関して心筋炎の報告は、77%が接種後7日以内、48%が48時間以内であった。
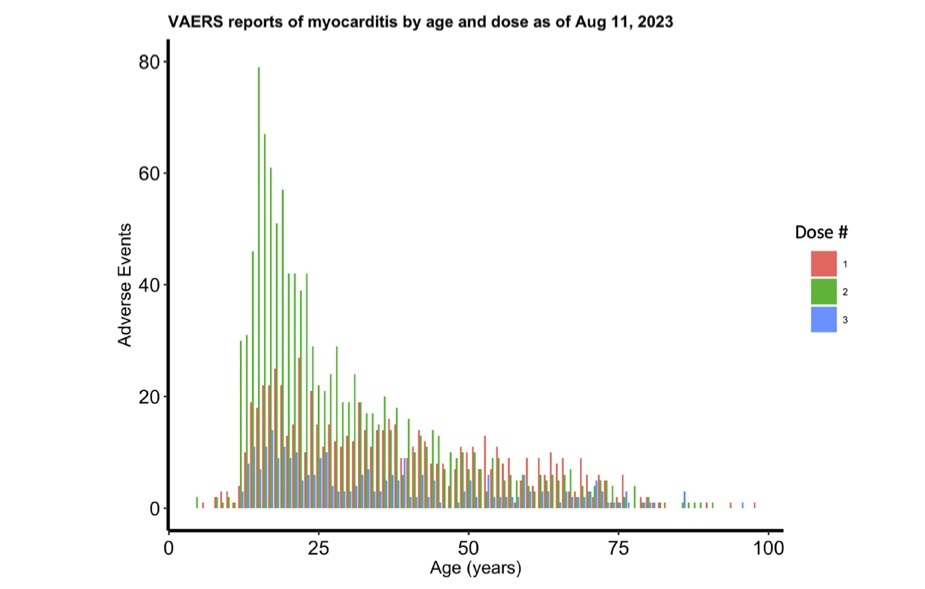
2021〜2023.8.11の調査機関におけるドーズ毎の心筋炎の報告数を1 ドーズ(ピンク)、2ドーズ(緑)、3ドーズ(青)で示してある
Rose J, et al. Determination of COVID-19 vaccine-induced myocarditis. Ther Adv Drug Saf 2024; 15: pp1-pp15のFigure 4より引用
総括として、
①VARESにおいて、COVID-19ワクチンキャンペーンが始まった2021年の心筋炎の報告数は、それ以前の過去30年のワクチンすべてを合わせた心筋炎の報告数の総数の年平均値の233倍の増加を認めた。
②これは実数としては、ワクチン接種が始まった最初の1年で2500%の増加にあたる。
③心筋炎の50%は若年者、69%は男性に発症していた。
④全体の76%が救命医療と入院を要し、3%にあたる92名が死に至った。
⑤心筋炎は2ドーズ接種後に発症しやすく、年齢が30歳以下のほうが発症しやすい傾向にあった。
一方、Tuvaliら(14)は、2020年3.7〜2021年1.31の期間イスラエルでワクチン未接種者グループががCOVID-19感染した後に心筋炎/心膜炎の発症が増えるのかどうかを COVID-19の感染既往のないグループと比較して報告している。COVID-19感染者は、CHS(Clalit Health Service: イスラエル最大の健康維持機関(USAでいえばHMOに相当))に登録されている18歳以上のPCRで検査で確定された213,624人から抽出された。この期間では、確定診断後最短で10日、最長で6ヶ月後に発症した心膜炎/心筋炎患者がカウントされていた(フォローアップは18〜6ヶ月の期間行われた)。最終的に完全にワクチン接種者を除いたデータとして①COVID cohort: (ワクチン未接種)∩(PCRで確定診断)∩(心膜/心筋炎), n-196,992、これに性別、年齢等をマッチさせた②Control Cohort: (ワクチン未接種)∩(COVID-19の既往感染なし)∩(心膜/心筋炎 ), n=590,976のtotal n=787,968でリサーチが行われた。重み付けとしてpreson-monthが単位に用いられている。この期間でCOVID Cohortでは心筋炎9例、心膜炎11例の発症が確認された。一方Control Cohortでは心筋炎27例、心膜炎52例の発症が確認された。log rank検定を行った結果確率の実現値は、心筋炎p=1.0、心膜炎p-0.17であった。これを用いて累積発症確率(≃発症リスクと読み替えられる)をカプランマイヤー曲線で表したものが図10である。
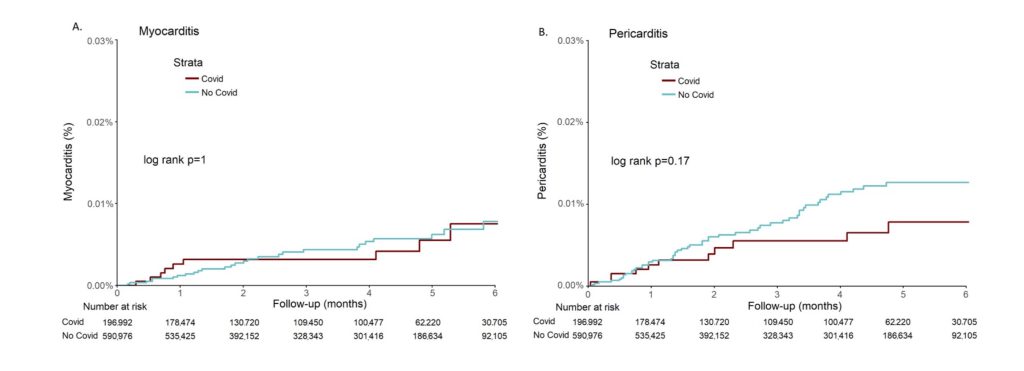
(A)心筋炎の累積発症確率 、(B)心膜炎の累積発症確率
Tuvali O, et al. The incidence of myocarditis and pericarditis in post COVID-19 unvaccinated patients-A large population-based study. J Clin Med 2022; 11: 2219.のFigure 2より引用
この結果からは両 Cohort間での発症率に統計学的差異は認められなかった。VAERSで確認されたワクチン接種後の心筋炎のデータを比較するとmRNAワクチン接種が心筋炎発症に関与している可能性が強く疑われる。
また、mansangusn S(15)らによるタイにおける314人の13~18歳のmRNAワクチン接種後の心血管症状の報告があるが、これによると最も頻度の高かった症状は頻脈(7.64%)で、それに続いて息切れ(6.64%)、動悸(4.32%)、胸痛(4.32%)、高血圧(3.99%)であった。心血管症状の発現は全体の29.24%に認められ、1例が心筋炎の確定診断、2例が心膜/心筋炎疑い症例であった。また5例はトロポニンT陽性であった。
(4)ACVS/PACVSが生じる機序に関して
①mRNAワクチン接種後に生成される抗受容体抗体について
Semmler Aら(16)は初回のmRNA COVID-19ワクチン接種者という条件のもとで、全く不定愁訴を示していない健常者(n=89)と慢性倦怠感、自律神経失調などの3種以上の愁訴が接種後5ヶ月以上の時点でも持続しているPACVS症例(n=191)の血液検査結果を比較し、抗受容体抗体や炎症マーカーの変化に相違があることを報告している。測定項目のターゲットとなる抗体は、以下の13個の受容体または酵素に向けた抗体である。(1)AT1R(アンギオテンシンII type1受容体)、(2)α1-adr-R(アルファ-1アドレナリン受容体)、(3)α2a-adr-R(アルファ-2Aアドレナリン受容体)、(4)α2b-adr-R(アルファ-2Bアドレナリン受容体)、(5)α2c-adr-R(アルファ-2Cアドレナリン受容体)、(6)β1-adr-R(ベータ-1アドレナリン受容体)、(7)β2-adr-R(ベータ-2アドレナリン受容体)、(8)〜(12)MIR-M5R(ムスカリン/アセチルコリン受容体M1~M5)、(13)ACE-II(アンギオテンシン変換酵素II)であった。また同時にIL-6(インターロイキン-6)、IL-8(インターロイキン-8)、CRP(C-反応性タンパク)などの炎症マーカーも測定された。その結果を図11に示す。
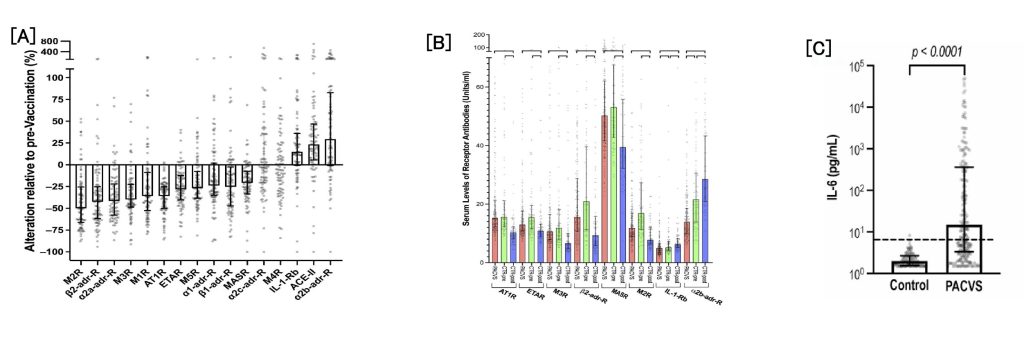
図11:COVID-19 mRNAワクチン接種後に出現する各種血清マーカーの変化:
[A] ワクチン接種後無症状の健常者血清での血清マーカーの変化
[B]ワクチン接種後の健常者(CTR)とPACVSの血清マーカーの定量値比較
[C]ワクチン接種後の健常者(CTR)とPACVSの血清IL-6の定量値比較
Pre-CTR/post-CTRはそれぞれ、無症状の健常者のmRNAワクチン接種 前/後の状態を示す。
PACVS: Post Acute COVID-19 Vaccination Syndrome
Semmler A, et al. Chronic fatigue and dysautonomia following COVID-19 vaccination Is distinguished from normal vaccination response by altered blood markers. Vaccines 2023; 11: 1642. のFigure 1, 2, 4より引用
図12[A]で認めらた現象であるが、健常者(CTR)のワクチン接種後の血清で、ATIR、ETIR、M1R、M2R、M3R、MASR、α1-adr-R、α2a-adr-R、β2-adr-R、MASRの血清抗体値は25~50%の低下を示していたが、IL-1-Rb、ACE-II, α2c-adr-Rは15~25%の増加を示していた。ワクチン接種後最低6か月間はこれらの受容体抗体の血中浮遊循環が維持されていた。これがmRNAワクチンに対する通常の液性免疫反応と考えられる。以上を踏まえたうえで図12[B]ではPACVSとmRNAワクチン接種後(post-CTR)の血清マーカーを比較しているが、CTR群で減少が認められた6つの受容体抗体(AT1R、ETIR、M3R、β2-adr-R、MASR)値が上昇していた。一方、IL-1Rbとα2b-adr-RはPACVSで群で低下していた。この8つ(AT1R、ETIR、M3R、β2-adr-R、MASR、IL-1Rb、α2b-adr-R)の受容体抗体は、PACVS群と健常者(post-CTR)で重複傾向なく明らかに異なる増減傾向を示すことからPACVSを診断する血清マーカーとして利用できるかもしれない。これらのマーカーは我が国の一般外注血液検査で多くが測定可能であるようだが健康保険適応はされる検査ではないので血清マーカーを用いた補助診断基準が早々に確立されることが望まれる。さらに血清IL-6の上昇はPACVS群では健常者(post-CTR)と比較して著明であり(図12[C])、IL-8の上昇と共役させるとさらにその傾向は顕著であった。上記8つのマーカーに加えてこの2つ(IL-6, IL-8)も鑑別に利用できるマーカーと考えられる。
②ワクチンに含まれる好ましくない不純物dsRNA
mRNAワクチンの精製純度のところでも述べたが、現行のmRNAワクチンにはdsRNAが少量ながらEMAの上限基準値を超えて含まれている。dsRNAは強力な免疫炎症反応を起こす外因性の誘因であることは上述してきた通りである。ワクチンに含まれるdsRNAが炎症反応を起こす機序を図11に示す。
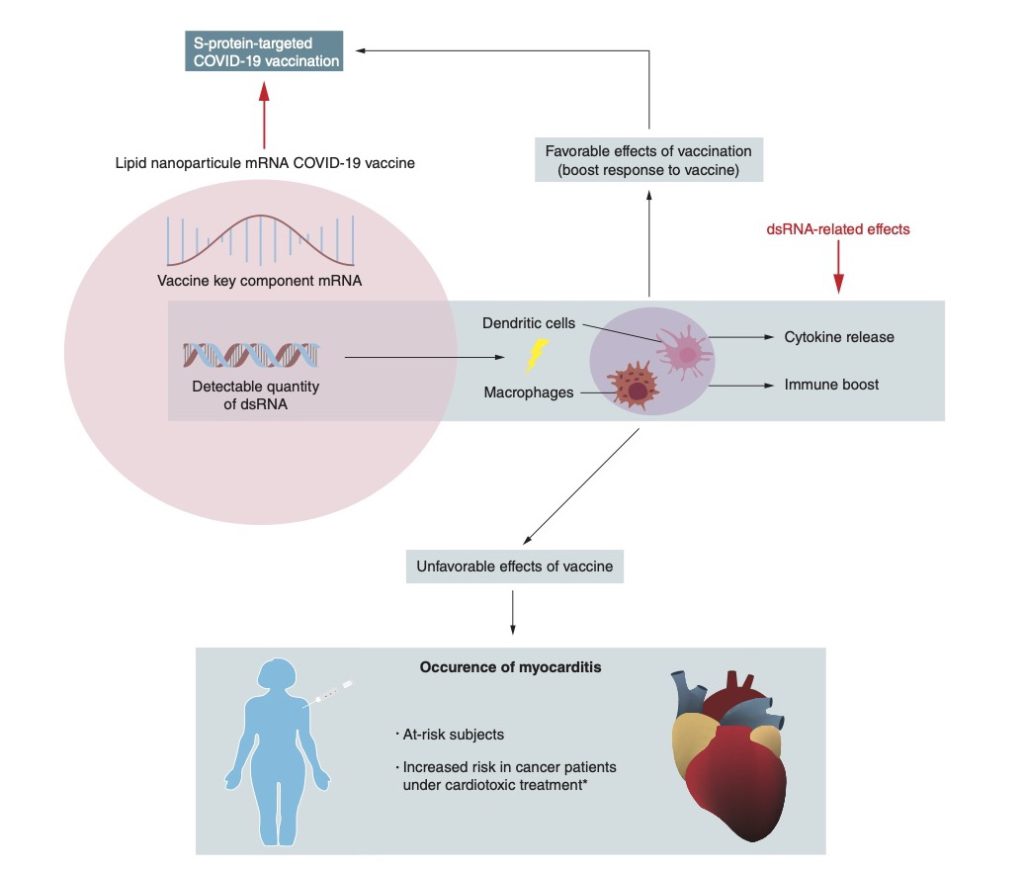
ワクチンに含まれるdsDNAは接種個体に強い炎症反応を引き起こす。
Milano G, et al. Myocarditis and COVID-19 mRNA vaccines: a mechanistic hypothesis involving dsRNA. Future Virol 2021;10: 2217/fvl-2021-0280. doi: 10.2217/fvl-2021-0280.のFigure 1より引用
局所投与されたワクチンに含まれるdsRNAは樹状細胞やマクロファージに捕捉されこれを起点に強い炎症反応が引き起こされる(17)。これらは心臓を含めて全ての臓器に悪影響を及ぼす可能性がある。
Uploaded on April 7, 2025
参考文献
- Fukushima M, Hirai y, et al. Overview of COVID-19 post vaccination mortality and pharmacoepidemiological evaluation: nation-wide view and a proposal. Clin Eval 2022; 49(3): pp499-517
- Schokmann F, May CA. COVID-19, post-acute COVID-19 syndrome(PACS, “long COVID”) and post-COVID-19 vaccination syndrome (PCVS, “post-COVIDvac-syndrome”): similarities and differencies. Pathology-Reserch and Practice 2023;246: https://doi.org/10.1016/j.prp.2023.154497
- Alfredo J, Castruitta S, et al. SARS-CoV-2 spike mRNA vaccine sequences circulate in blood up to 28 days after COVID-19 vaccination. APMIS 2023; 131: 128–132
- Yonker LM, Swank Z, et al. Circulating spike protein detected in post-COVID-19 mRNA vaccine myocarditis. Circulation 2023; 147: pp867-876 DOI: 10.1161/CIRCULATIONAHA.122.061025
- Kariko K, Buckstein M, et al. Supression of RNA recognition by toll-like receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005; 23: pp165-pp175
doi:10.1016/j.immuni.2005.06.008 - kariko K, Muramatsu H, et al. Generating the optima; mRNA for the therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acids Research, 2011; 39(21): e142 doi:10.1093/nar/gkr695
- E. Cott, et al.: How Pfizer Makes Its Covid-19 Vaccines. The New York Times, April 28, 2021
- Gholamalipour Y, Mudiyanselage AK, et al. 3′ end additions by T7 RNA polymerase are RNA self-templated, distributive and diverse in character––RNA-Seq analyses. Nucleic Acids Research 2018; 46(18): 9253–9263 doi: 10.1093/nar/gky796
- Yoshida T, Yamashita T, et al. Consideration for evaluation of mRNA therapeutics. 医薬品医療機器レギュラトリーサイエンス 2023; 54(4): pp322-239
- Assessment report: cominaty. https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report en.pdf
- Assessment report: COVID-19 vaccine Moderna. https://www.ema.europa.eu/en/documents/assessment-report/covid-19-vaccine-moderna-epar-public-assessment-report en.pdf
- McKerman K, Helbert Y, et al. Sequencing of bivalent Moderna and Pfizer mRNA vaccine reveals nanogrm to microgram quantities of expression vector dsDNA per dose. OSFREPRINTS
- Rose J, Hulsher N, et al. Determination of COVID-19 vaccine-induced myocarditis. Ther Adv Drug Saf 2024; 15: pp1-pp15
- Tuvali O, Tshori S, et al. The incidence of myocarditis and pericarditis in post COVID-19 unvaccinated patients-A large population-based study. J Clin Med 2022; 11: 2219.
https://doi.org/10.3390/jcm11082219 - Mansanguan S, Charunwatthana P, et al. Cardiovascular manifestaion of the BNT162b2 mRNA COVID-19 vaccine in adolescents. Trop Med Infect Dis. 2022;7: https://doi.org/10.3390/tropicalmed7080196
- Semmler A, Mundorf AK, et al. Chronic fatigue and dysautonomia following COVID-19 vaccination Is distinguished from normal vaccination response by altered blood markers. Vaccines 2023; 11: 1642. https://doi.org/10.3390/vaccines1111164
- Milano G, Gal J, et al. Myocarditis and COVID-19 mRNA vaccines: a mechanistic hypothesis involving dsRNA. Future Virol 2021;10: 2217/fvl-2021-0280. doi: 10.2217/fvl-2021-0280.
編集後記:院長の独り言
2年ほど前に集団接種でmRNAワクチン接種後、動悸や息切れ、高度の頭痛、起立不耐症などを愁訴に受診した若年から中年患者を複数症例拝診させていただいたが血液検査、心電図、心エコー、頭部MRIなどではこれが原因と特定できる異常を指摘できず、少量のβ遮断薬で対症療法をうけていただいた。これで症状が改善されたのか以後不調を愁訴に来院はされていない(もしくはもっと高レベルで診てくれる医療機関をさがして転医したのか?)。当初このような症状を強く訴える方は、副腎ホルモン(コルチゾール/アルドステロン)値の低下していた場合がそこそこの認められたのでmRNAワクチンは一過性の副腎機能低下をおこすのではないかと考えていたがおそらく体内のどこへmRNAが集積したかの単なる確率的問題であったのかもしれない。
実際に困っている方々は、上述してきたPACVSの中核症状を発現している方で、これがmRNAワクチンを接種したことによるPTSDなのか、血清学的/診断学的にPACVSという診断カテゴリーに収めるべき病態なのかはチャレンジングな状況であり、早々にこの宙ぶらりん状態を解決する診断基準の策定が必要であろう。