好酸球性血管浮腫 : Angioedema with Eosinophilia : AE
好酸球性血管浮腫は、Quinche浮腫を代表とする浮腫の亜分類にあたるが発症頻度が極めて低い稀な疾患であり、下記の2タイプに分類される。いずれも原因に関しては現時点では解明されていない(1)。
①反復性好酸球性血管浮腫 (Episodic Angioedema with Eosinophilia: EAE):周期性で四肢に対称性、時に顔面の浮腫を生じ、蕁麻疹、発熱、体重増加などを伴う。
②非反復性好酸球性血管浮腫(Non Episodic Angioedema with Eosinophilia: NEAE):周期性がなく四肢に対称性に浮腫を生じる。その他の全身症状は伴わない。
①は西洋諸国、②はアジア(特に日本と韓国がほとんど)に認められる人種特異性のある特発性浮腫であるがいずれも末梢血好酸球増多を特徴とする(2)。共にに硬性浮腫(non-pitting edema)を基本症状としている。蕁麻疹を伴わないAEの有病率は1.6〜2.2%と報告されている(3)。浮腫の発症機序としては、EAEでは好酸球の皮膚浸潤と好酸球からのロイコトリエンC4(LTC4)やmajor Basic Protein(MBP)放出によって刺激された活性化肥満細胞からのヒスタミンが血管透過性を亢進させ血管性浮腫を引き起こすのではないかと考えられている(4)。Nakachiらによる11症例のNEAEの検討(2006年1月〜2010年12月)では、全例若い女性に認められており、来院時末梢血好酸球数は7,839 ± 6,008 (2,130-23,170)/μL であり、好酸球増多は約8週間にかけて漸減していきfollow up期間で再発は認めていない(5)。NEAEでは、コルチコステロイド治療を必要とすることはEAEに比べて少ない。血液検査では特に末梢好酸球数増加以外に所見は認められず、NEAEはEAEの軽症型であるとも見方もある。いずれにしてもEAE/NEAEは、好酸球増加症候群(Hypereosinophilic Syndrome: HES)とは異なり臓器浸潤による機能不全を生じることはなくself-limitingな一面もあり良性疾患と言える。NEAEの皮膚生検では血管周囲の好酸球浸潤が確認されている(1)。診断基準として統一されたものは出ていないようであるが、除外診断および臨床経過から診断がなされている。EAEとNEAEの特徴を下記表にまとめてみた。
| EAE | NEAE | |
| 周期性(再燃性) | 再燃あり | 再燃なし |
| 臨床所見 | 体重増加 蕁麻疹 熱発 手背、足背の浮腫 | 手背、足背の浮腫 |
| 血液検査 | 好酸球増加 IgM上昇 LDH上昇 | 好酸球増加のみ |
| 治療 | しばしばプレドニゾロン | 抗ヒスタミン剤? |
[Case presentation]
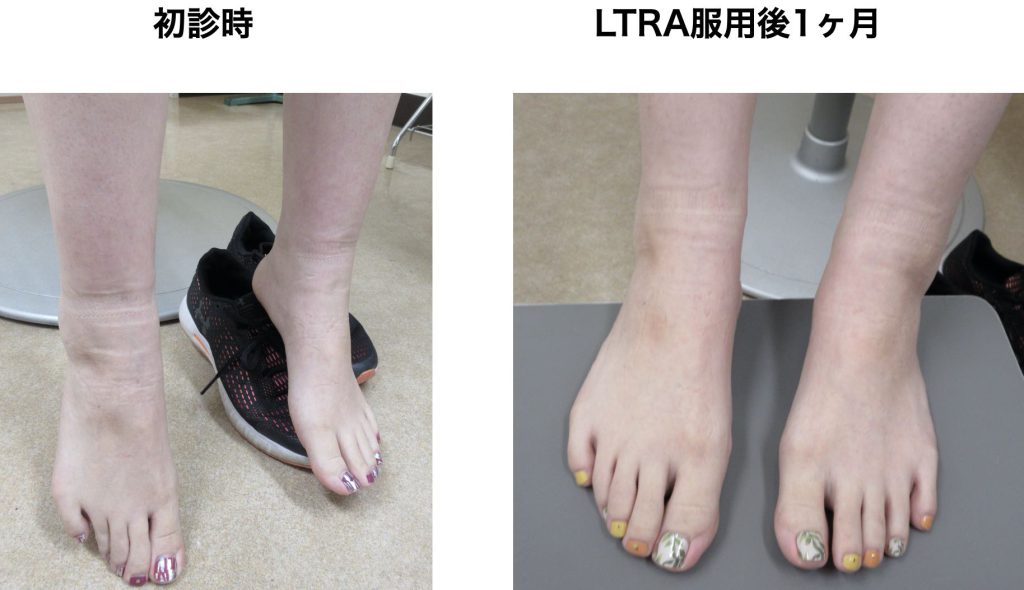
[CC] BNT162b2 2回接種完了後1ヶ月経過した時点から増悪する両下腿の硬性浮腫、および、両手のグリップの違和感
[PH] 37 y.o. female 特に既往症なし
[BC] WBC 15,100 /μL, Eosino 55%, RBC 458 x10*4/μL, Hb 14.4 g/dL, Ht 40.2 %, Plt 33.3 x10*4/μL, ESR 4/12 mm(1h/2h) , CRP 0.04 mg/dL, s-Ferritin 19.0 ng/mL
Alb 3.9 g/dL, T.Bil 0.2 mg/dL, AS 14 U/L, ALT 9 U/L, GGT 9 U/L, ALP(JSCC) 159 U/L, CHE 263 U/L, BUN 14 mg/dL, Cr 0.50 mg/dL, eGFR 108.6 ml/min/1.73m*3, Na 137 mmol/L, K 4.1 mmol/L, Cl 105 mmol/L, Ca 9.0 mg/dL, BS 118 mg/dL, HbA1c=5.5%, s-Renin 4.5 ng/mL/h, s-Aldosterone 50.8 pg/ml, PAC/PRA 11.3, TSH 3.60 μU/mL, f-T4 1.02 ng/dL, IgG 844 mg/dL, IgA 89 mg/dL, IgM 89 mg/dL, IgE(RIST) 49.6 IU/ml, RF 6.5 ng/mL, ANA(FEIA) (-)
[Interval Change of the Peripheral Blood Count] 1月に受けた健診データがあるため、末梢血好酸球数の時系列が追えるが、時系列データが添付してある報告症例はPubmedで検索しえた範囲では見つけることができなかったので典型的な経過であるのかどうかはわからない。好酸球性副鼻腔炎の治療ガイドラインに従い、初診後2W後からロイコトリエン受容体拮抗薬(LTRA; モンテルカスト(R))を投与したが、服用後は末梢血所見はスムーズに軽快している。*LTRAを治療薬として使用した報告症例も検索しえた範囲では見当たらなかった。3回目のBNT162b2接種を受けたのち、再び末梢好酸球数の増加傾向を認めたので再びLTRAの内服開始により再燃には至っていない。
| 2021.1月 | 初診(7月) | 14日後 | 28日後 | 49日後 | 63日後 | 91日後 | 3回目ワクチン 接種後 10日後 | |
| WBC (/μL) | 7300 | 15100 | 18000 | 12300 | 6300 | 5900 | 6000 | 4800 |
| Eosino (%) | 3.9 | 55.0 | 65.0 | 53.0 | 17.0 | 9.0 | 4.0 | 5.2 |
| Neu (%) | 62.5 | 44.0 | 12.0 | 26.0 | 48.0 | 48.0 | 60.0 | 48.5 |
| Lym (%) | 29.8 | 10.0 | 19.0 | 19.0 | 32.0 | 36.0 | 32.0 | 41.3 |
| RBC ( x 10*4/μL) | 455 | 458 | 435 | 429 | 440 | 454 | 429 | 424 |
| Hb (g/dL) | 13.9 | 14.4 | 13.6 | 13.2 | 13.6 | 13.9 | 13.5 | 13.0 |
| Ht (%) | 40.8 | 40.2 | 38.6 | 38.2 | 39.1 | 39.5 | 39.2 | 38.3 |
| Plt ( x 10*4/μL) | 34.0 | 33.3 | 35.6 | 34.0 | 33.3 | 33.8 | 33.3 | 33.9 |
[Image Findings] 両下腿前面~足背に浮腫を認め、特に下腿前面の緊満感が目立つ。初診時両手と両足首の緊満感が主訴であった。2W皮膚経過観察したところ、さらに末梢血好酸球数が増加(10,000 /μL 以上)となったのでLTRAの内服を開始したところ服用開始後1か月で自覚症状は消失、末梢血好酸球数は漸減し治療開始後11Wで罹患前の末梢血所見に回復した(皮膚生検は施行していない)。
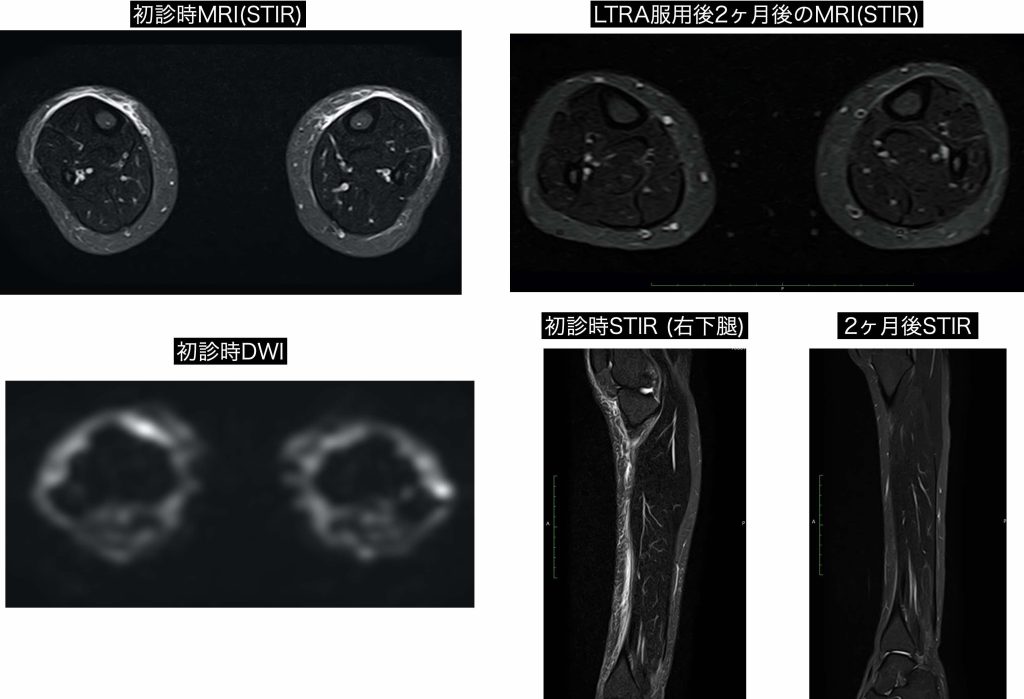
[MRI Findings] 浮腫を鋭敏に検出できる撮影方法であるSTIRおよびDWIにて下腿の前面、筋膜との境界面に高信号帯を認める。通常の重力浮腫のように全周性に高信号域が認められないのは特徴的所見と考えられるがNEAEのMRI画像に関する報告症例をPubmedでは見つけることが出来なかったため特異的な所見であるかどうかは断定できない。右下腿矢状断像では浮腫は膝下前面に広範囲に存在することが分かる。LTRA服用開始後2か月で高信号域はほぼ消失していた。
BNT162b2投与を機転に発症したと考えられるAE症例は今のところ昨年9月にIshizukaらが報告したもの1例のみであるが、年齢77歳の高齢日本人女性で末梢血好酸球数は3750/μLと少しNEAEの典型症例とは異なる印象はある(6)。当症例を含めて少なくとも2例はmRNAワクチン接種後にNEAEが発症しており、発生頻度が極めて稀な疾患であることを考えるとCovid19 mRNAワクチンは誘発リスク因子の一つと考えてよいのではないかと思われる。
Uploaded on 3 Feb, 2022.
個々の症例のデータ、画像の引用または転載を一切許可しない。
参考文献
1. Jung JS, Kim C-H, et al. A case report of nonepisodic angioedema with eosinophilia in a Korean patient and a review of the Korean literature. Korean Journal of Internal Medicine 2006: 21: pp275-278.
2. Hiramatsu-Ito M, Nakamura N, et al. Case Report: Non-episodic Angioedema With Eosinophilia in a Young Lactating Woman. Frontiers in Immunology 2021; 12: 627380
3. Cho HJ, Yoo HS, et al. Clinical Characteristics of Angioedema With Eosinophilia. Allergy Asthma Immunol Res. 2014; 6(4): pp362-365.
4. 豊田 雅夫, 鈴木 大輔, et al. 著名な好酸球増多と浮腫を認めた2例. 日腎会誌 2001; 43(1): pp44-48.
5. Nakachi S, Inokuma S. Eleven cases of angioedema with eosinophilia treated in a single hospital in Japan. Allergology International. 2012;61: pp259-263. DOI: 10.2332!allergolint.11-OA-0351
6. Ishizuka K, Katayama K, eta al. Non-episodic angioedema with eosinophilia after BNT162b2 mRNA COVID-19 vaccination. An International Journal of Medicine, 2021, pp1–2.
[院長の独り言]
BNT162b2の審議結果報告書にある3H 標識ルシフェラーゼ遺伝子発現 mRNA-LNP の分布 (p16)によると、ラットにRNA量として50μg単回筋注投与後48時間後までの組織分布は、投与部位の放射能濃度でみると投与1時間後で最高値394 μg lipid eq./g、48時間後で165 μg lipid eq./gとなっている。筋注後BNT162b2は局所にとどまっているわけではなく、投与部位以外で放射能が認められた主な組織は、肝臓、脾臓、副腎及び卵巣であり、投与 8~48 時間後に最高値(それぞれ 26、23、18 及び 12 μg lipid eq./g)となっている。従って上記臓器は条件によっては何らかの副反応を伴う可能性があリ得る。このためコントロール困難な肝疾患はあらかじめ治験対象とはなっていなかったことは周知のことと思われる。実際のところ副反応は軽微のものを含めるとそこそこに認められ、帯状疱疹や接種後から治療が必要なレベルの高血圧の出現などは外来で経験される。アナフィラキシーや神経失調性失神でない限り大部分の副反応を施注医が診ることはないであろうから実際のところ施注医は結果を知らないであろうし報告には上がらない場合が多いと考えられる。因果関係を証明するのが困難なのは当たり前であるが、少なくとも突き止めようとする努力はしてあげるべきであろう。組み替え蛋白を用いたNOVAVAXワクチン が隣国の韓国で未接種者や1,2回目で副反応の激しいかった症例を対象に今月半ばには解禁となる。日本でも申請はなされているので韓国に続いて同じような条件で解禁となると思われるがそもそもこのワクチンが早々に解禁されていれば子供の接種に親が悩む必要はないように思える。オミクロン株が主体となるにつれ重症化のリスクは低くなっているのは確かそうであるが、これは血栓塞栓症の発症頻度が低くなったことに関係していると推定される。そもそも新型コロナウイルス感染症が脅威であるのは肺炎を生じるからではなく、サイトカインストームにより(微小)血栓塞栓症を併発することで突然ECMOの世話になるようなショック状態に陥るからである。風邪と同系列に並べることが出来ないことは、臨床医であれば疑う余地もないがこのことはきちんと一般市民に明示しなければ理解できるはずもない。ACE2受容体を侵略する基本感染形態はオミクロン株、また今後の変異株でも変化することはないであろうから血栓塞栓を併発するリスクがゼロになようなことがにわかに起こるとは思えない。血栓塞栓症という観点から見ると新型コロナウイルス感染症の重症化因子は、心房細動のCHADS2スコアとほとんどオーバーラップしておりスパイクタンパク自体が血管毒であるという説に同調したくもなる。