自己複製型mRNAワクチン(以下saRNAワクチンと略称)が今回新たに市場投入されたことで注目されている。saRNAワクチンの構造、特性を理解するためには現存しているmRNAワクチンの総括をした上で、比較するのが理解を容易にすると思われる。
まずは、この記事を読み進めていく上での必須のテクニカルタームを列挙する(1,2,3)。
◯真核生物: Eukaryotaと言われる分類群で、核膜に包まれた(細胞核)を持つ細胞から構成されている生物を示し、地球上に存在する動物、植物などほとんどが真核生物である。
◯ゲノム(genome): 1つの細胞が持つDNAの基本セット。この中に遺伝子(gene)と呼ばれる”タンパク質の設計図”が含まれている。
◯Toll-like Receptor: トル様受容体(TLR)はマクロファージや樹状細胞などの表面にあるパターン認識受容体(pattern recognition receptor: PPR)タンパクで、微生物もつ共通した分子構造(pathogen-associated molecular pattern: PPMP)を認識する。種々の病原体をパターン(PPMP)認識することで自然免疫を発動させる。
◯mRNA: メッセンジャーRNAの略号で、アデニン(A)、ウラシル(U)、グアニン(G)、シトシン(C)の4塩基の様々な順列を基本構造にもつ。mRNAはDNAから転写されたタンパク質合成の鋳型としての役割を担う。
◯CAP構造:キャップ構造はmRNAの5’末端に確認される特徴的な構造(5’末端塩基のリン酸が3つ結合した三リン酸に7-メチルグアニンが5’−5’向きに結合したもの)で、主としてmRNAの5’末端の保護や翻訳開始(リボゾームの結合)を促進する。真核生物のmRNAには天然のCAP構造が備わっている。CAP-0, CAP-1の2種類があるが、mRNA人工合成の際には通常CAP-1構造を組み込む。
◯ポリA構造:ポリA鎖と呼ばれmRNAの3’末端に確認される特徴的な構造(アデニン塩基が複数個連なったもの)で、主としてmRNAの細胞質での分解を保護し翻訳終了を補助する、
◯ウリジン(uridine):RNA配列に特有のウラシル(U)がリボース環にβ-N1-グリコシド結合で接合したもの。
◯N1-methylpseudouridine(1mψ):1メチルシュードウリジンと呼ばれ、リボース環とウラシルの間のグリコシド結合のN-C結合がC-C結合に置き換わり、ピリミジン環のN1位の水素がメチル基に置き換わったウリジンの異性体。カリコーらはmRNAのウリジンをシュードウリジンに置換することで生体が本来持つ自然免疫から回避されることを発見した。SARS-COV2ワクチンのシュードウリジンにの構造には開発各社の特許があり市場参入当初から情報オープンになっているのはモデルナ社製品のみである。
◯DDS: Drug Delivery Systemの略号で薬物送達技術のことを指す。mRNAは単独で投与するとすぐに自然免疫で捕捉、分解されるため目的の細胞に速やかに到達する様に標的指向型DDSの付加が必要となる。
◯リポ脂質ナノ粒子:Lipid Nano Particle(LNP)は負の電荷を持つRNAを細胞膜(脂質二重膜)に包み込み正の電荷を膜表面に装備したDDSの1手法である。これにより懸濁液(生理食塩水)中においてもクーロン斥力によりLNSが一箇所に集積しない様になっていると考えられる。
◯ポリエチレングリコール: polyethylene glycol(PEG)は、エチレングリコール(C2H6O2)の重合体で–(CH2CH2O)nR(R=CH3)の構造式を持つ水に溶けやすく、毒性が低い高分子化合物である。分子量が20kDa以上あるものは心臓、肝臓、肺へ長時間停滞する傾向があると言われている。
◯リボソーム:リボソームタンパク質とリボソームRNAから構成される複合体で、mRNA上を移動し、mRNAの配列(コドン)を読み取ってたんぱく質を合成する。大小2つのサブユニットで構成される。
◯サブユニットタンパク:複数の異なるタンパク質の分子が複合体を形成して何らかの生理機能を発現している場合の個々の構成タンパクをサブユニットとよぶ。SARS-COV2のスパイクタンパクはS1サブユニット、S2サブユニットの2つのサブユニットで構成され、S1サブユニットの頂点の部分にRBD(受容体結合ドメイン)が存在する。
◯アルファウイルス:トガウイルス科(family Togaviridae)に属するプラス1本鎖のRNAゲノムを保有するφ70mmほどのエンベロープを持つ正20面体ウイルスで、SARS-COV2 saRNAにはゲノムにベネズエラウマ脳炎ウイルス(VEEV)や西武ウマ脳炎ウイルス(WEEV)などが使用されている。
◯レプリカーゼ:RNA replicaseはRNAの複製に関与する酵素で、1本鎖プラスRNAを鋳型に相補的な1本鎖マイナスRNAを合成する。その逆も可能。
◯ベクター: ウイルスベクターとプラスミドベクターの2種類が汎用されている。外来遺伝子(発現させたいタンパク質の遺伝子など)を人為的に目的の細胞に運び込むために利用するDNA(またはRNA)分子である。ウイルスが持つ病原性に関する遺伝子(構造タンパクのgene)を排除して、合成したいタンパク質の遺伝子をその部分に組み込んだものがウイルスベクターでアデノウイルスやレトロウイルスなどを利用したものがある。プラスミドベクターは細菌(大腸菌など)に存在する自己増殖DNA(プラスミド)に合成したいタンパク質の遺伝子を組み込んだものでcDNAクローニングなどに汎用される。
◯シェディング:ウイルス排出(Viral shedding)とは遺伝子治療薬や増殖性ウイルス等のウイルスをベースとする医薬品を臨床で使用する場合、患者に投与されたウイルスやベクターが患者の排泄物や体液等を介して排出されることを示す。
①まず今期の接種選択肢となっているSARS-COV2(新型コロナウイルス)ワクチンについて
10月から接種可能なコロナワクチン は、サブユニット(リコンビナント)ワクチン、従来型mRNAワクチン、saRNAワクチンの3種類が用意されている。下表に薬品名、販売元、等の情報をまとめたものをアップした。いずれもJN.1系統対応ワクチンである。
| 商標名 | コミナティー筋注 | コミナティーRTU筋注 | コミナティー筋注シリンジ | スパイクバックス筋注 | ダイチロナ筋注 | コスタイベ筋注用 | ヌバキソビット筋注 |
| ワクチンの種類 | mRNA | mRNA | mRNA | mRNA | mRNA | saRNA | リコンビナント |
| 製薬会社 | ファイザー | ファイザー | ファイザー | モデルナ・ジャパン | 第一三共 | Meiji Seika ファルマ | 武田 |
| 対象年齢 | 6ヶ月〜4歳 | 5~11歳 | 12歳以上 | 6ヶ月以上 | 12歳以上 | 18歳以上 | 6歳以上 |
| 接種方法 | 筋注 | 筋注 | 筋注 | 筋注 | 筋注 | 筋注 | 筋注 |
| 用量 | 1回0.3ml | 1回0.3ml | 1回0.3ml | 12歳未満 1回0.25ml 12歳以上 1回0.5ml | 1回0.6ml | 1回0.5ml | 1回0.5ml |
②従来型mRNAワクチンに関しての総括(see→case24-8-p1, case24-8-p6, case24-11 )
メッセンジャーRNAを用いたワクチンで、2020年に初めて人体使用が暫定認可されたワクチンあることは周知のことであろう。mRNAを直接投与するとTLRを介したした自然免疫が発動する。これはIFN-1などのサイトカインの放出を伴う強い炎症反応を伴う。それ故、mRNAはそのまま単独皮下、筋注投与では早々に免疫システムに捕捉され分解されてしまうため、臨床応用するためには自然免疫反応を抑制して、速やかに細胞質内にmRNAを取り混ませるデリバリーシステム(DDS)の開発が必要であった経緯がある。Karikoらは2005年に、RNAのウリジンを1メチルシュードウリジンに置換/修飾することでこの自然免疫の発動を抑制することができることを報告している(4)。その派生体としてスパイクタンパク(Sタンパク)の遺伝子を一部修飾する(1mψ)ことでSARS-COV2 mRNAワクチン(BNT162b2(ファイザー)、mRNA-1273(モデルナ))は、実用化に至った。またDDSに関しては細胞内への取り込みを増強するリポ脂質ナノ粒子(LNP)が開発され、mRNAをLNPで包み込むことで効率的にエンドソームからの脱出、その後のmRNA放出が可能となった。
肝心の予防効果であるが、当初の治験成績からは重症化予防効果は95%前後と見込まれたが実臨床での結果が蓄積されるとmRNAワクチンの効果は6ヶ月経過するとほぼベースライン近くにまで経時的な減衰を示すことが明らかとなり、3回目のブースター接種を行わざるを得ない状況に至っている(発症予防効果に関しては添付文書には明示されてはいない)。変異株の出現に伴い4回目以降のブースター効果持続が困難なことが報告され始めたことを踏まえて、世界基準では3回以上の追加接種を推奨しないという方針が落とし所となっている。どの国でもパンデミック対策に膨大な額の税金が投入されていることを考慮した上で費用対効果を考えると妥当な舵取りであろう。
筋注した後のmRNAの分布を追跡する目的でルシフェラーゼを用いたラットの実験結果では、肝臓、脾臓、副腎、卵巣などが主な集積部位と報告されていた。このことを踏まえてBNT162b2の添付文書では、重篤な肝疾患患者に対しては慎重投与とされていた。筋注した部位にmRNAワクチンは留まるとの文言がいつどこから正当化されたのかは不明であるが明らかな誤認識と言える。
mRNAワクチン接種の副反応としては、発熱(高熱)、注射部位の発赤、腫脹、疼痛、全身倦怠感がほぼ必発で大部分を占めるが、死亡に至る様なアナフィラキシーショックが目立つことには注意が必要である。ナノ粒子(LNP)にプラス荷電を与えるために脂質膜の外側にPEGが付加されているが添付文書ではこのPEGは施注後速やかにNPから分離すると報告されている。PEGは化粧品や下剤、医療物品に含まれているため女性や下剤の常用者、医療従事者は日頃からPEGに感作されている可能性が高く恐らくこの様な方がワクチン接種後に重篤なアナフィラキシーショックを起こしているのではないかと推定する。この意味では施注後30分以内だけ注意すれば良いのではなく、翌朝の化粧時、下剤服用時などの際の再度の抗原暴露により致命的なショックに至っている症例があるのではないかと思われ施注後2-3日は経過観察が必要であろう。スパイクタンパクはACE2受容体を占拠することから血管毒性が高いと考えられその暴露によりACE2ブロックに由来すると考えられる高血圧や血栓塞栓症(脳梗塞、心筋梗塞、肺血栓塞栓症など)などが生じうると考えらる。これらは同時にSARS-COV2感染症の重篤な合併症でもある。ワクチン接種後の帯状疱疹出現や黄斑変性症、認知症の進行、リンパ腫、自己免疫疾患の発症などワクチン接種との関連性を否定し難い症例が臨床諸家で経験されているので長期経過後の副反応に関しては今後も監視していく必要がある。
③次世代型mRNAワクチンであるsaRNAワクチンとは
mRNAワクチンの欠点は、流通量を担保するためには大量のRNAを必要とするためコストがかかりすぎること、製品の保管に厳格な温度管理(-60度〜-80度: BNT162b2)を必要であること、使用に至るまでの過程が煩雑であること、不活化ワクチン等と比較して副反応が強く出ることにある。より効率的にコマーシャルベースに乗せるためにはワクチン1回分に必要なRNAの量を極力減らしてコストダウンと副反応が軽減できれば理想的である。この欠点を補填するワクチンとしてsaRNAワクチンが開発された。
saRNAワクチンは、アルファウイルスの遺伝子骨格をベースに設計されている(アルファウイルスのゲノム は約12kb)(5)。アルファウイルスの病原性を決定する遺伝子(構造タンパクの設計図にあたる部分)を削除しこの部位にSARS-COV2ウイルスのS(スパイク)タンパクをコードする遺伝子を組み込んだ形となっている。下図(図1)は、アルファウイルス、SARS-COV2ウイルス、mRNAワクチン、saRNAワクチンのゲノム 構造を模式化したものである。
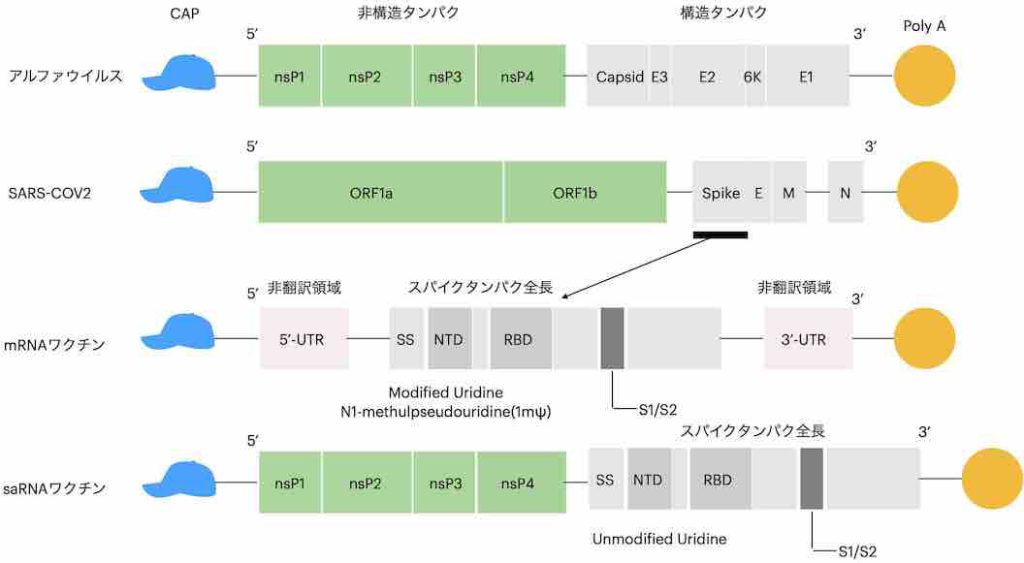
mRNAワクチンとsaRNAの構造を比較すればどのような工夫がなされたか明白であるが、saRNAワクチンに組み換えされているSARS-COV2ウイルスのS蛋白をコードする遺伝子はシュードメチルなどの人工産物の修飾を行っていないウイルス本来の遺伝子をそのまま使用したものである(この方式ではウリジンの修飾は必要ない)。これによりアルファーウイルスの非構造タンパクを用いてスパイク蛋白の合成が可能となる。簡単に言うと、mRNAワクチンに翻訳開始に必要な装備をall in oneに詰めましたという感じである。ただしアルファウイルスの病原性のもとになる構造タンパクの遺伝子がすべて排除されているためこれは、ただSタンパクを合成するだけの代物ではあるが、厳密な意味ではウイルスベクターに分類されるRNA断片である。
次にsaRNAが細胞内に取り込まれたのち、生体内でどのようにスパイク蛋白の合成をおこなわれるかについて図を用いて理解を深めたいと思う。saRNAもDDSとしてLNPを利用している。LNPにより細胞質に入りこんだ(≒感染)saRNAは、宿主リボゾームによりまずレプリカーゼの複製が行われる(図2)。このアルファウイルス由来のRNAレプリカーゼは、RNAを5’→3’、3’→5’の双方向に複製することが可能であるのでプラスRNA鎖→マイナスRNA鎖→プラスRNA鎖と通常のウイルス感染時の増幅メカニズム同様にsaRNAゲノムが複製されていく(自己複製)(6)。そしてプラスRNA鎖からはサブゲノムとしてS蛋白(スパイク蛋白)が合成される。合成されたS蛋白は細胞表面に発現しこれをTLR細胞が認識するがこれは従来型mRNAワクチンと同じである。
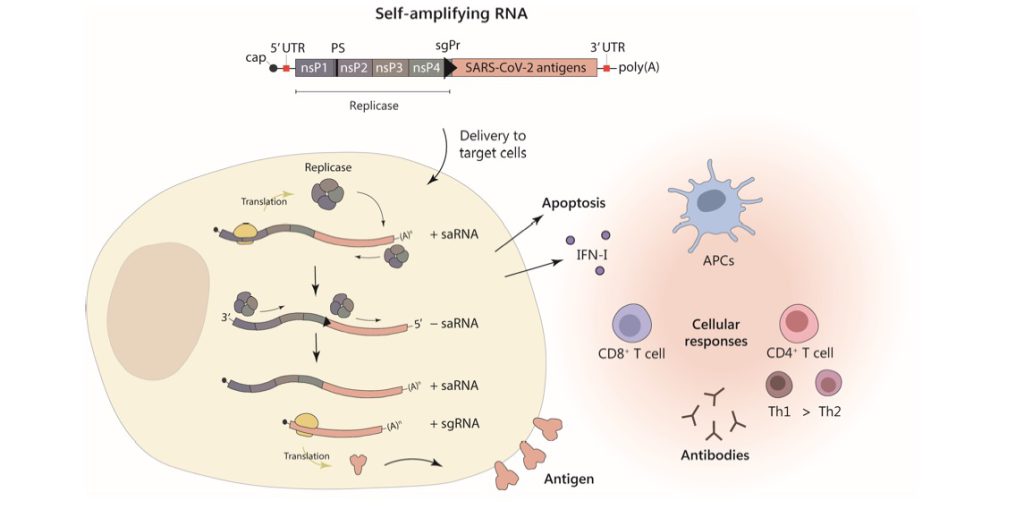
この様にsaRNAはプラス鎖RNAを自分で増やすことが出来るのが特徴であり、これによりmRNAワクチンのRNA投与量の1/5程度に投与量を減らすことが可能となっている。一般論として、saRNAベクターによるSタンパクの合成は遺伝子導入した細胞のアポトーシス(細胞死)するため2〜3日で停止すると言われている(6)。ベクターを用いた遺伝子治療などを行う際にはシェディングや細胞DNAへの組み込みが懸念されるが、saRNAの転写はリボゾームで行われる(核内ではない)ので上記の心配する必要はないと言える。しかしながら、基本的にはmRNAワクチンと同様の機序で免疫誘導されるので副反応もほぼ同等なものが出現するであろうことは容易に予見される。
③saRNAワクチンの治験結果について
saRNAワクチンを用いた治験としては、VLPCOV-01(7), VLPCOV-02(8)、ARCT-154(9)を用いて行ったものが報告されており、前者はphase1 study、後者はphase 3b studyまで報告されている。
VLPCOVはアルファウイルス(ベネズエラ馬脳炎ウイルス(VEEV))にSARS-COV2 SタンパクのRBDドメイン遺伝子を組み込んだデザイン、ARCT-154はアルファウイルス(ベネズエラ馬脳炎ウイルス(VEEV))にD614G変異株のSタンパクの全長を組み込んだデザインとなっている。今回コスタイベ筋注用(Meiji Seika ファルマ)の治験となっているのがARCT-154なのでこれに関して少し言及しておく。
Phase1-3の治験は、ベトナム(16施設)で行われたもので2021.8.15~2023.1.12までの登録期間に、phase1 100人、phase2 300人、phase 3a 600人、phase 3b 16,000人規模でそれぞれ免疫原性と安全性に関しては投与後210日まで追跡していた。1dose施注から4週間後に2dose目を施注し、それから1週間後に副反応の評価、4週間後に免疫原性を評価するスケジュールとなっていた。Phase 1では18-60歳が登録対象と若年層が対象であったが、Phase 3bでは60歳以上の年齢も投与対象として含まれていた。
免疫原性の評価では従来型mRNAワクチン(BNT162b2)に対してGMT(幾何平均抗体価)で非劣勢が確認されかつ、若干優越性が認められた。これは起源株(delta株相当)、omicron株(BA 4/5)、のいずれにおいても同様であった(図3, 4)。
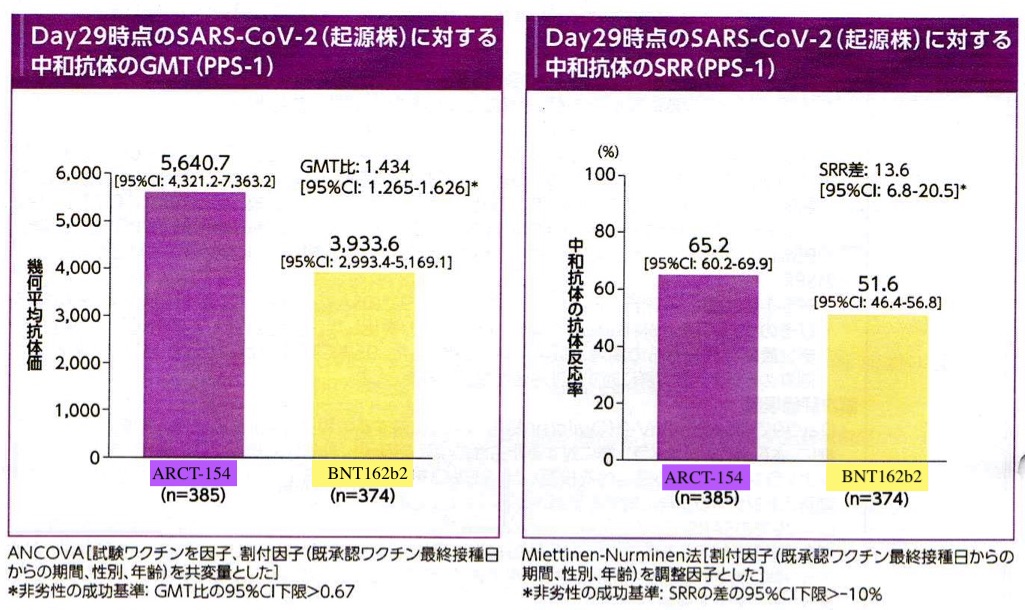
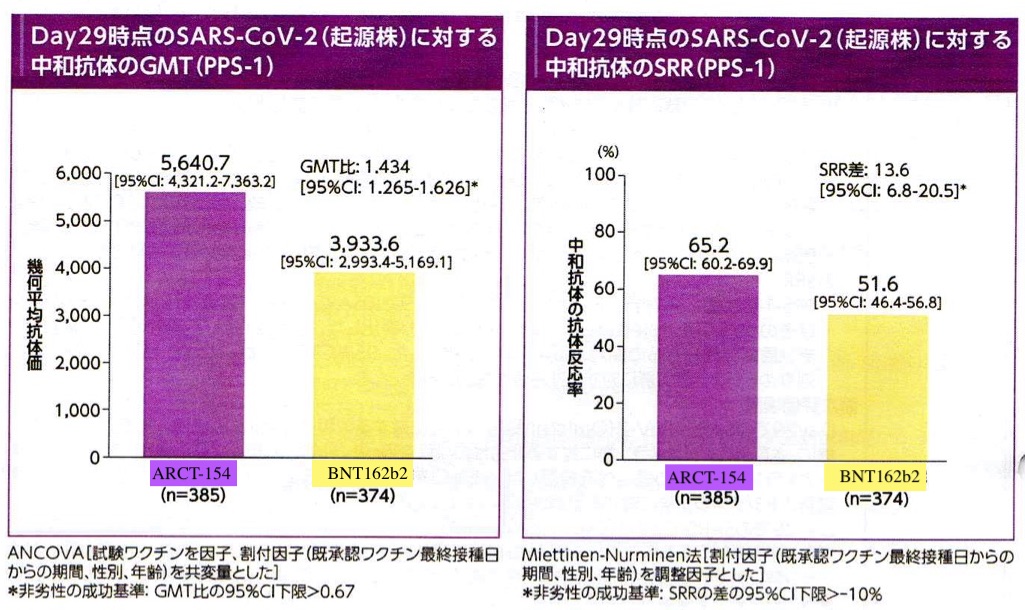
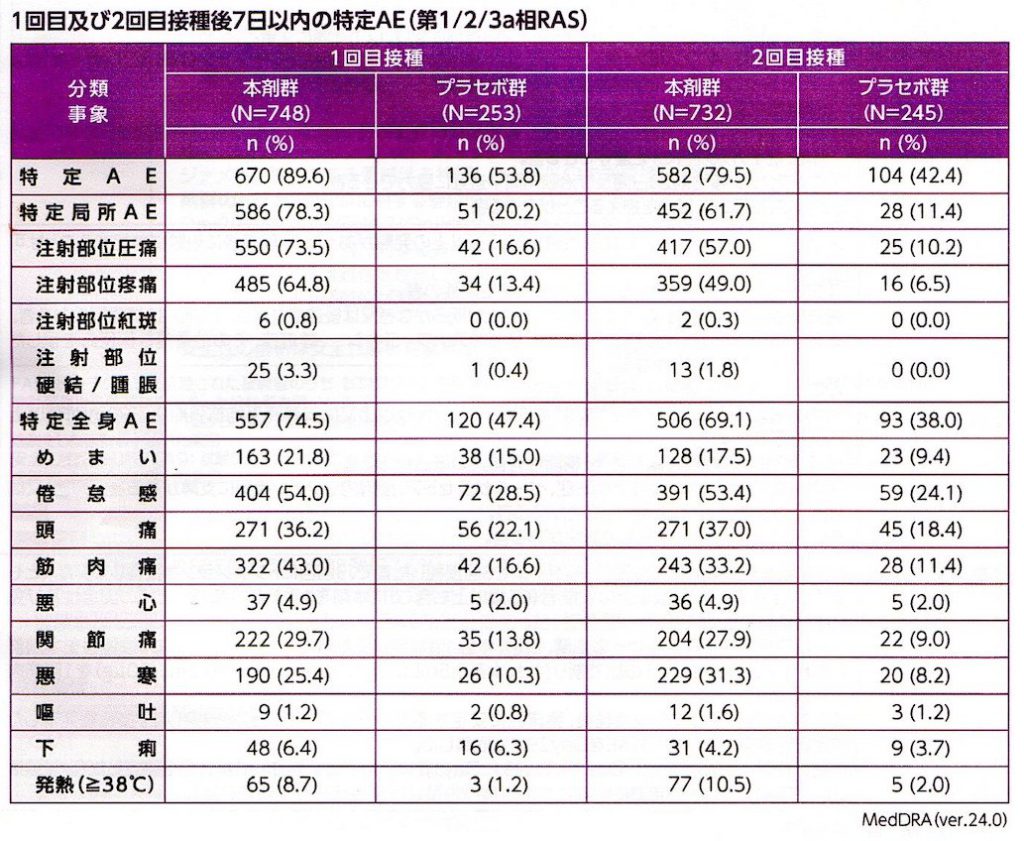
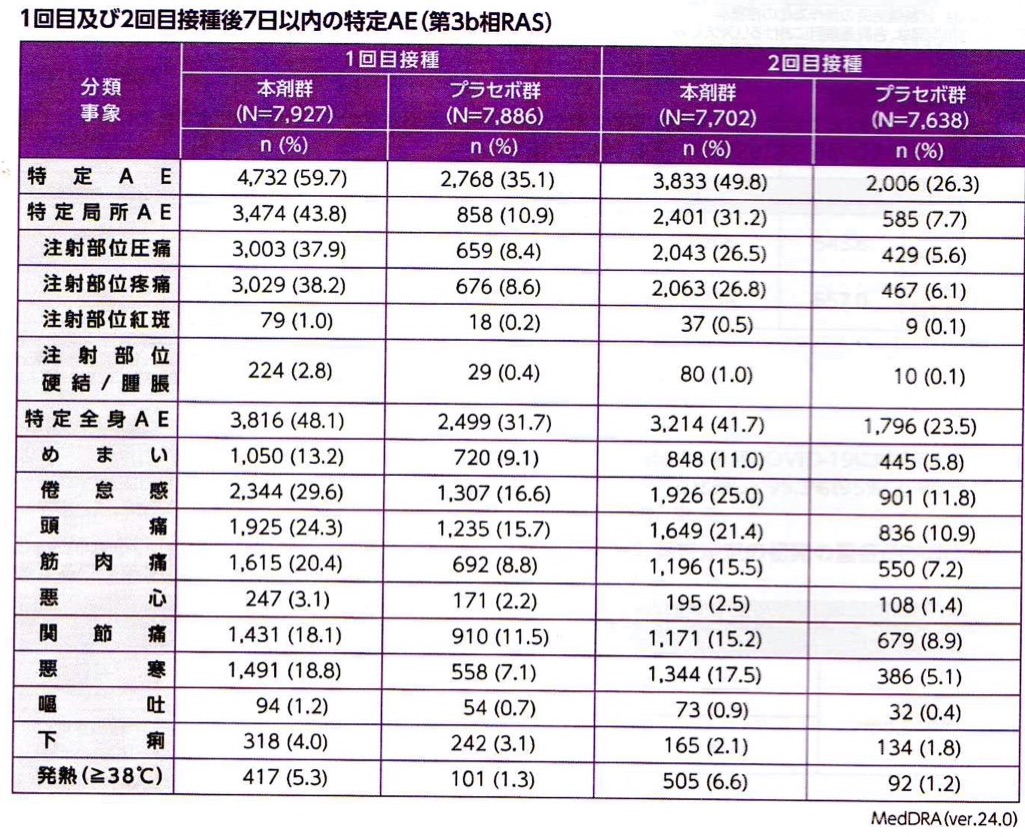
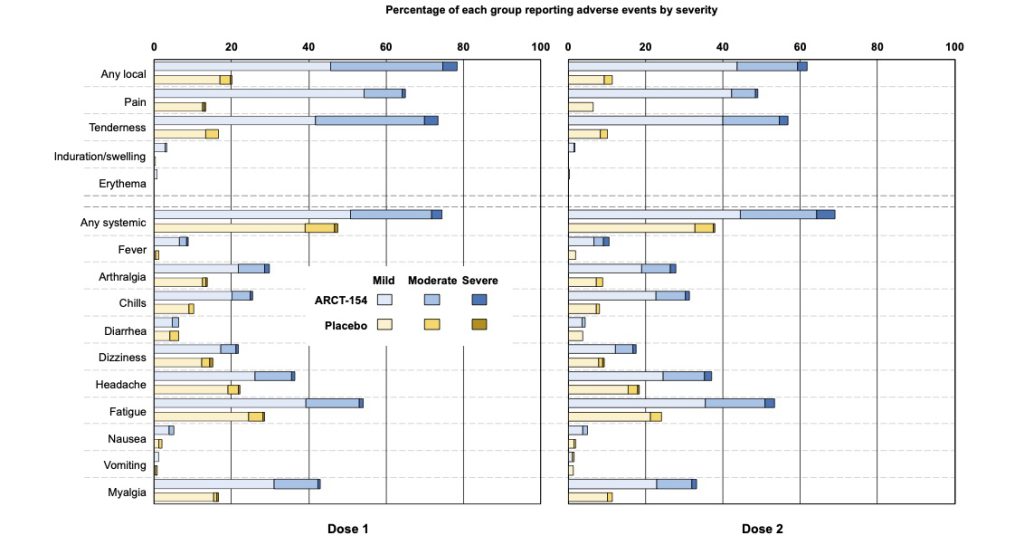
接種後1週間の時点で評価された副反応は、ほぼ従来型mRNAワクチンで想定される範疇のもので大部分は発熱、注射部位の疼痛、腫脹、全身倦怠感であり今のところsaRNAワクチン特異的な副反応は報告されてはいない (表3,4, 図5)。
10月から導入されるSARS-COV2ワクチンは、いずれもJN,1系統のゲノム を用いたワクチンとなっており治験に用いたものとは異なり、変異に対応する塩基配列が数カ所異なっているはずである。現在の新型コロナ感染症自体が軽症化していることからもスパイクタンパクの毒性も低下していると考えられる。このJN,1株のsaRNAの人体投与はぶっつけ本番であるが、弱毒化したと想定されるスパイク蛋白が、デルタ株のスパイク蛋白よりも問題を起こすことはないであろう。
updated on Sept 30, 2024.
院長のひとりごと
mRNAワクチンが導入されて3年以上が経過したが、副反応と安全性に関しては未だグレーゾーンにある。mRNAワクチンの重篤副反応の背景には3つの因子が関与しているのではないかと考えます。①医原性要因、②含有されている成分に由来する要因、③ACE2ブロックに伴う要因である。①の要因は施注前の温度管理、溶解/希釈過程にあると考えられ、医療従事者には耳の痛いところである。当初は倍量投与したといったような事故が散見されたことを考えるとmRNAが本当に均等量施注されていたかどうかは?である。②の要因によると思われる症例は、ワクチン接種後から全身に皮疹が出現し改善しない症例(小生もこの方を拝診させていただいた)、PEGが原因なのかその他の成分なのかはっきりしない様なものがどうやらある様だ。一時期は異物混入騒動もあったが、実際のところ突貫作業で作成しているためどのくらいの純度のものができていたのか?いらぬ憶測をしてしまうのは小生だけではないだろう。③に由来するのは、接種後に心筋梗塞や脳血管障害を生じたケースと考えられ、これはそこそこの症例数があるはずで小生の知人にもその様な方はいる。今のところ、小生のクリニックに相談に来院される方は重篤な修復困難症例ではないのは幸いである。不幸にも死亡に至った方々には心からお悔やみ申し上げます。
一方で、saRNAは改良型mRNAワクチンといった位置づけにあり、mRNAワクチンが最初に導入された時ほどのインパクトはないし、組み替えされているSタンパクも起源株に手を加えずそのまま挿入されているところを考えると当初のmRNAワクチンほど目くじらを立てる様な代物でない様に感じる。しかしながら、想定外の副反応が出てくる可能性も否定はできないので厳重に監視していく必要があるだろう。
参考文献
1. Lubert Stryer: ストライヤー生化学. 東京化学同人
2. 森 嘉生, 大槻 紀之, et al. トガウイルスのウイルス学. ウイルス 2001: 第61巻 第2号; pp221-230
3. 増田 道明. 新型コロナウイルスのウイルス学的特徴. モダンメディア 2020: 第66巻 第11号; pp313-320
4. Kariko K, Buckstein M, et al. Suppression of RNA recognition by toll-like receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity, 2005: Vol. 23; pp165–175
DOI 10.1016/j.immuni.2005.06.008
5.Schmidt C,Schnierle BS. Self-Amplifying RNA Vaccine Candidates: Alternative Platforms for mRNA Vaccine Development. Pathogens 2023, 12, 138. https://doi.org/10.3390/pathogens12010138
6.Silva-Pilipich N, Beloki U, et al. Self-Amplifying RNA: A Second Revolution of mRNA Vaccines against COVID-19. Vaccines 2024, 12, 318. https://doi.org/10.3390/vaccines12030318
7. Akahata W, Sekida T, et al.Safety and immunogenicity of SARS-CoV-2 self- amplifying RNA vaccine expressing an anchored RBD: A randomized, observer-blind phase 1 study2023, Cell Reports Medicine 2003; 4: 101134 http://creativecommons.org/licenses/by-nc-nd/4.0/
8.Aboshi M, Matsuda K, et al. Safety and immunogenicity of VLPCOV-02, a SARS- CoV-2 self-amplifying RNA vaccine with a modified base, 5-methylcytosine. iScience 27, 108964, February 16, 2024 https://doi.org/10.1016/j.isci.2024.108964
9.Hồ NH, Hughes SG, et al. Safety, immunogenicity and efficacy of the self-amplifying mRNA ARCT-154 COVID-19 vaccine: pooled phase 1, 2, 3a and 3b randomized, controlled trials. Nature Communication 2024: 15; 4081